
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是
①.25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
②.由0.2 g H2和8.8 g CO2、5.6 g CO组成混合气体,其密度是相同状况下O2密度的0.913倍
③.100 mL 2.0 mol·L-1 NH4Cl溶液中含有NH4+ 的数目为0.2NA
④.常温常压下,NO2与足量H2O反应生成0.1molNO,则转移的电子数为0.2NA
⑤.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
⑥.56 g铁片投入足量浓H2SO4中生成NA个SO2分子
A. ①②③④ B. ②④⑤ C. ②⑤⑥ D. ③④⑥
【答案】B
【解析】①.不正确,因为溶液的体积不知道,无法计算离子数目;②.由0.2 g H2和8.8 g CO2、5.6 g CO组成混合气体,其平均相对分子质量=![]() =29.2。根据阿伏加德罗定律可知,在相同条件下,不同气体的密度之比等于其相对分子质量之比,所以其密度是相同状况下O2密度的
=29.2。根据阿伏加德罗定律可知,在相同条件下,不同气体的密度之比等于其相对分子质量之比,所以其密度是相同状况下O2密度的![]() 0.913倍,该项是正确的;③.因为在水溶液中铵根会水解,所以100 mL 2.0 mol·L-1 NH4Cl溶液中含有NH4+ 的物质的量小于0.2mol,数目小于0.2NA,该项不正确;④.常温常压下,NO2与足量H2O反应生成0.1molNO,N元素的化合价由+4降到+2,所以转移的电子数为0.2NA是正确的;⑤.乙烯和丁烯的最简式相同,都是CH2,所以21.0g乙烯和丁烯的混合气体中含有的CH2的物质的量为
0.913倍,该项是正确的;③.因为在水溶液中铵根会水解,所以100 mL 2.0 mol·L-1 NH4Cl溶液中含有NH4+ 的物质的量小于0.2mol,数目小于0.2NA,该项不正确;④.常温常压下,NO2与足量H2O反应生成0.1molNO,N元素的化合价由+4降到+2,所以转移的电子数为0.2NA是正确的;⑤.乙烯和丁烯的最简式相同,都是CH2,所以21.0g乙烯和丁烯的混合气体中含有的CH2的物质的量为![]() =1.5mol,所以碳原子数目为1.5NA是正确的;⑥.56 g铁片的物质的量为1mol,投入足量浓H2SO4中,如果温度为常温,则发生钝化,铁不能完全被氧化,无法计算生成SO2分子数;如果在加热条件下,铁可以全部被氧化为Fe3+,转移电子3mol,则可以生成1.5molSO2分子,即生成1.5NA个SO2分子,所以该项不正确。
=1.5mol,所以碳原子数目为1.5NA是正确的;⑥.56 g铁片的物质的量为1mol,投入足量浓H2SO4中,如果温度为常温,则发生钝化,铁不能完全被氧化,无法计算生成SO2分子数;如果在加热条件下,铁可以全部被氧化为Fe3+,转移电子3mol,则可以生成1.5molSO2分子,即生成1.5NA个SO2分子,所以该项不正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
A. 9.2g NO2和N2O4的混合物中含氮原子数目为0.2NA
B. 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA
C. 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA
D. 已知反应N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ
2NH3(g)△H=-92.4kJ mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑。请根据你所学知识回答:
(1)太阳能热水器吸热涂层常使用一种以镍或镍合金空心球做吸收剂,则基态镍原子的外围电子排布式____________。
(2)由氧、镍和碳三种元素组成的化合物四碳基镍[Ni(CO)4]为无色挥发性剧毒液体,熔点-25℃,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂,四碳基镍的晶体类型是_________,写出一种与配体等电子体的化学式___________________。
(3)三氟化氮在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4NH3=NF3+3NH4F,生成物NH4F固体所含化学键类型是_____________。往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。己知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_____________________。
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硒化镓、硫化锌薄膜电池等。
①砷和稼的第一电离能关系为:As_____Ga(填“>”、“<”或“=”)
②SeO2分子的空间构型为________。
③硫化锌的晶胞结构如右图所示,锌离子的配位数是______。

己知此晶胞立方体的边长为a pm ,晶体的密度为ρg/cm3,则阿伏加德罗常数可表示为__________mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于原子序数的说法正确的是
A. 原子序数与原子核电荷数一定相等
B. 原子序数与微粒的核外电子数一定相等
C. 短周期中,原子的最外层电子数随着原子序数的增加而增加
D. 原子序数为16,核外电子数也为16的原子,其质量数为32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
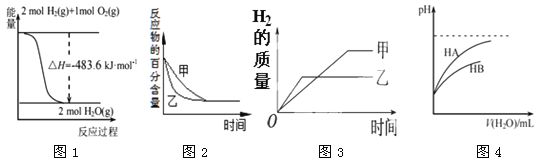
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明氯元素比硫元素非金属性强的是
①HC1比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成s ④Cl2比S更易与H2化合生成相应气态氢化物 ⑤盐酸是强酸,而氢硫酸是弱酸
A. ①②③④⑤ B. ①②④⑤ C. ①②③④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO等,工艺流程简化示意图如下:
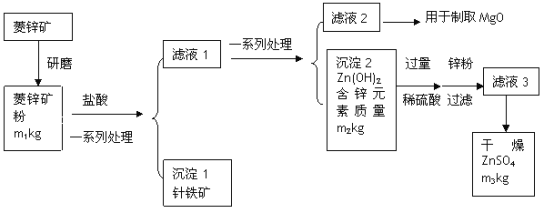
根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是使_____________________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数∶氧原子数∶氢原子数=________。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式________________________。该反应的基本类型是_____________。
(4)“滤液3”之前加入锌粉的目的是__________________。
(5)“滤液3”之后的操作依次为________、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于___________×100%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大。W、Z同族,Y、Z位于同周期且相邻,W、Y、Z三种元素原子的最外层电子数之和为11,X原子最外层电子数等于最内层电子数的一半。下列说法正确的是
A. W的最高价氧化物是大气污染物之一
B. X、Y、Z的离子半径逐渐增大
C. X的最高价氧化物的水化物能分别与Y、Z的最高价氧化物对应水化物反应
D. 最简单氢化物的热稳定性:Z > W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于同主族元素从上到下的下列说法不正确的是( )
A. 原子半径依次增大B. 金属性逐渐增强
C. 非金属性逐渐减弱D. 原子得电子能力逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com