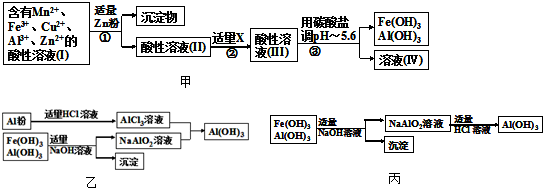
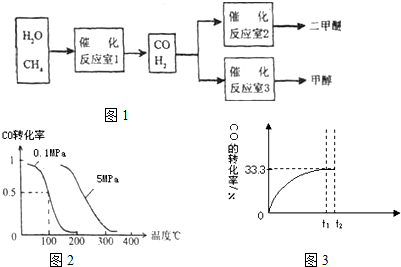
二甲醚和甲醇被称为21世纪的新型燃料,以CH
4和H
2O为原料制备二甲醚和甲醇的工业流程如图1:
I:(1)在一定条件下,容积为 100L密闭容器中发生反应:CH
4(g)+H
2O(g)?CO(g)+3H
2(g);△H>0
将1.0mol CH
4和2.0mol H
2O(g)通入该密闭容器 l0min时有0.1mol CO生成,则10min内该反应的平均速率v(H
2)
0.0003mo1?L-1?min-1
0.0003mo1?L-1?min-1
.
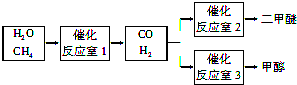
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H
2在催化剂作用下反应生成甲醇:CO(g)+2H
2(g)?CH
3OH(g)平衡时CO的转化率与温度、压强的关系如图2.
①该反应的△H
<
<
0 (填“<”、“>”或“=”).
②100℃时该反应的平衡常数K=
(用含a、V的代数式表示).
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H
2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“减小”或“不变”).平衡常数
不变
不变
(填“增大”、“减小”或“不变”)
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H
2反应生成CH
3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的
0.55
0.55
倍.
II:某温度下,向密闭容器中充入2.0mol CO和1.0mol H
2O,发生反应:
CO(g)+H
2O(g)?CO
2(g)+H
2(g).CO的转化率随时间变化关系如图2,回答下列问题:
(1)如果一个可逆反应的平衡常数K值很大,下列说法正确的是
C
C
(填字母).
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应达平衡时至少有一种反应物的百分含量很小
D.该反应一定是放热反应 E.该反应使用催化剂意义不大
(2)t
2时刻向平衡体系中再通入1.0mol H
2O(g),请在原坐标图3中将改变这一条件后CO的转化率的变化结果表示出来.

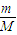 、w%=
、w%=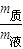 来计算.
来计算.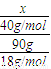 =
=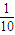 ,解得x=20g,
,解得x=20g,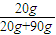 ×100%=18.2%,
×100%=18.2%,

 阅读快车系列答案
阅读快车系列答案