
某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。
(1)基态氮原子的核外电子排布式为 。
(2)与N互为等电子体的离子有 (任写一种)。
(3)工业上用氧化铝与氮气和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,其化学式为 ,工业制备X的化学方程式为______________________。
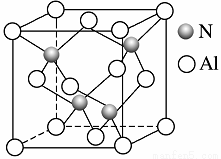
(4)X晶体中包含的化学键类型为________(填字母)。
A.共价键 B.配位键 C.离子键 D.金属键
X晶体中氮原子的杂化类型为________杂化。
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是
。
(6)若X的密度为ρ g·cm-3,则晶体中最近的两个Al原子的距离为 cm。(阿伏加德罗常数的值用NA表示)
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源:2015-2016学年山西省高一下期中化学试卷(解析版) 题型:填空题
氮化镁是科学家们制备的一种重要化合物,它可由单只直接化合而成,它与水作用的产物之一为NH3。请回答下列问题:
(1)Mg3N2是由______键形成的_____化合物,写出它的电子式:_______。
(2)Mg3N2与水反应属于__________ (填基本反应类型),写出该反应的化学方程式:_____________。
(3)Mg2+与N3-的半径关系是Mg2+_____(填“>”、“<” 或“=”)N3-。
(4)Mg3N2与盐酸的反应生成_____种盐,用电子式表示其中只含有离子键的盐的形成过程_____,写出另一种盐的电子式_____。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:选择题
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH—4e-=4H2O O2+2H2O+4e-=4OH- 据此作出判断,下列说法中错误的是( )
A.供电时的总反应是:2H2+O2=2H2O
B.产物为无污染的水,属于环境友好电池
C.燃料电池的能量转化率无法达到100%
D.H2在负极发生还原反应
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市等十校高三3月联考理综化学试卷(解析版) 题型:实验题
新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
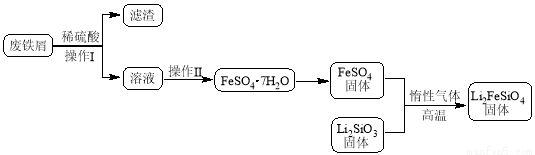
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:

从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省宁波市等十校高三3月联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.按系统命名法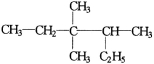 的名称为3,3—二甲基—2—乙基戊烷
的名称为3,3—二甲基—2—乙基戊烷
B.乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应
C.分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种
D.A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第六次适应性考试理综化学试卷(解析版) 题型:选择题
在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
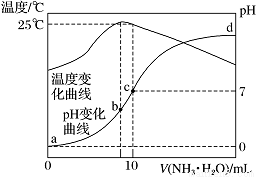
A.n=1.0
B.水的电离程度:b>c>a>d
C.c点:c(NH)=c(Cl-)=1.0 mol·L-1
D.25 ℃时,NH4Cl的水解常数(Kh)计算式为=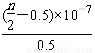
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第八次模拟理综化学试卷(解析版) 题型:推断题
【化学一一选修5:有机化学基础】芳香族化合物A含有碳、氢、氧三种元素,相对分子质量为136,能与NaHCO3反应产生CO2,核磁共振氢谱显示A分子内含四种氢(原子个数比为1:2:2:3;A用KMnO4加热氧化成B,B的相对分子质量为166;当A与碱石灰共热时得化合物C,C的相对分子质量为92,通常用作有机溶剂;C被KMnO4氧化后生成D,D在浓硫酸催化下加热与乙醇反应生成E,E通常情况下为液体,可用于配制依兰型香精和皂用香精,其相对分子质量为150。
已知:(1)KMnO4可将甲苯氧化为苯甲酸(2)冰醋酸与碱石灰共热后脱羧得到甲烷。
请回答下列问题:
(1)A中含有的官能团名称是 ,D转化为E的反应类型是 。
(2)B与足量NaHCO3反应的化学方程式是 。
(3)C与Cl2在光照条件下1:1反应的有机产物的结构简式是 。
(4)E在一定条件下可转化为D,反应的化学方程式是 。
(5)A的同分异构体有多种,其中一种F能发生银镜反应,能与金属钠反应放出氢气,但不能与Fe3+发生显色反应,其核磁共振氢谱显示有5种不同环境的氢原子(原子个数比为1:2:2:2:1),则F的结构简式为 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第二次模拟理综化学试卷(解析版) 题型:填空题
氨在生活、生产、科研中有广泛用途。
(1)已知反应Ⅰ:2NH3(g) +CO2(g) =NH2CO2NH4(s) △H=?159.5 kJ/mol
反应Ⅱ:NH2CO2NH4(s) =CO(NH2)2 (s)+ H2O(g) △H=+116.5 kJ/mol
反应Ⅲ:H2O(l) = H2O(g) △H=+44.0 kJ/mol
则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________,该反应在____________条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
5N2(g)+6H2O(l) △H<0,相同条件下在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
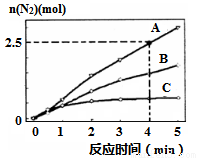
①0~4分钟在A催化剂作用下,反应速率υ(N2)=______;
②下列说法正确的是____________;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea (C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10-10。
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=______________________;
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=______________________;
②计算得到可逆反应AgCl (s)+2NH3(aq) Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=_________,1 L 1 mol/L氨水中最多可以溶解AgCl________mol(保留2位有效数字);
Ag(NH3)2+ (aq)+Cl-(aq)的化学平衡常数K=_________,1 L 1 mol/L氨水中最多可以溶解AgCl________mol(保留2位有效数字);
(4)工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2=CH—CN),该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏六盘山高中高一下期中化学试卷(解析版) 题型:选择题
下列物质中既含有共价键又含有离子键的是
A.HF B.NaCl C.HCl D.K2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com