���𰸡�
��������1����ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ���ݴ���д��ע����塢��Һ�岻��Ҫд����
�ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ����ݴ��жϣ�
��2�������ʱ��Ũ����Qc���жϷ�Ӧ���з�������μӷ�Ӧ��COΪamol����������ʽ��a��ʾ��ƽ��ʱ����ֵ����ʵ�������Ӧǰ������Ļ�ѧ���������䣬�������ʵ�������Ũ�ȴ���ƽ�ⳣ������ʽ�з��̼���a��ֵ�������������ɵĶ�����̼��
����v=
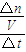
����v��CO
2����
����ת���ʵ��ڼ���CO��ƽ��ת���ʣ�
��1�����ϼ����ߵ�Ԫ�ر�������
��2����Ӧ��KOCN��N
2��NԪ�ػ��ϼ���-3������Ϊ0�ۣ�������6�ۣ�Cl
2��KCl��ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ�������2�ۣ����ϼ�������С������Ϊ6����N
2ϵ��Ϊ1��Cl
2ϵ��Ϊ3�����ԭ���غ���ƽ�������ʵ�ϵ����
��3�������ˮ��KCN���������ٸ���n=
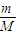
����KCN�����ʵ�����ʹKCN��ȫת��Ϊ�����ʣ�����CO��N
2������������CԪ�ػ��ϼ���+2������Ϊ+4�ۣ�NԪ�ػ��ϼ���-3������Ϊ0�ۣ�ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ����ݵ���ת���غ����n��Cl
2�����ٸ���m=nM������Ҫ������������
����⣺��1�����淴Ӧ��

Fe
2O
3��s��+CO��g��?

Fe��s��+CO
2��g����ƽ�ⳣ������ʽk=
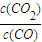
��
�ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ��
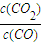
������
��2����ʱŨ����Qc=1��С��ƽ�ⳣ��4����Ӧ������Ӧ���У���μӷ�Ӧ��COΪamol����

Fe
2O
3��s��+CO��g��?

Fe��s��+CO
2��g��
��ʼ��mol����1 1
�仯��mol����a a
ƽ�⣨mol����1-a 1+a
��Ӧǰ������Ļ�ѧ���������䣬�������ʵ�������Ũ�ȼ���ƽ�ⳣ������
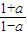
=4�����a=0.6��
��v��CO
2��=

=0.006mol/��L?min����
CO��ƽ��ת����Ϊ
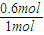
×100%=60%��
�ʴ�Ϊ��0.006mol/��L?min����60%��
��1����Ӧ��CԪ�ػ��ϼ���KCN��+2������ΪKOCN��+4�ۣ�CԪ�ر�������
�ʴ�Ϊ��C��
��2����Ӧ��KOCN��N
2��NԪ�ػ��ϼ���-3������Ϊ0�ۣ�������6�ۣ�Cl
2��KCl��ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ�������2�ۣ����ϼ�������С������Ϊ6����N
2ϵ��Ϊ1��Cl
2ϵ��Ϊ3�����ԭ���غ���ƽ�������ʵ�ϵ����ƽ���ʽΪ��2KOCN+4KOH+3Cl
2�T2CO
2+N
2+6KCl+2H
2O��
�ʴ�Ϊ��2��4��3��2��1��6��2��
��3����ˮ��KCN������Ϊ650mg/L×20L=13000mg=13g�����ʵ���Ϊ
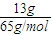
=0.2mol��ʹKCN��ȫת��Ϊ�����ʣ�Ӧ����CO��N
2������������CԪ�ػ��ϼ���+2������Ϊ+4�ۣ�NԪ�ػ��ϼ���-3������Ϊ0�ۣ�ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ�����ת���غ��֪2×n��Cl
2��=0.2mol×��4-2��+0.2mol×[0-��-3��]�����n��Cl
2��=0.5mol������Ҫ����������Ϊ0.5mol×71g/mol=35.5g��
�ʴ�Ϊ��35.5��
��������������ƴ������Ŀ���漰��ѧƽ�ⳣ����Ӱ�����ء���Ӧ���ʼ��㡢������ԭ��Ӧ���������ƽ������ȣ��Ѷ��еȣ�ע���3���и��ݵ���ת���غ���㣬���Լ��㣮

 Fe2O3��s��+CO��g��?
Fe2O3��s��+CO��g��? Fe��s��+CO2��g��
Fe��s��+CO2��g��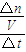 ����v��CO2����
����v��CO2����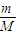 ����KCN�����ʵ�����ʹKCN��ȫת��Ϊ�����ʣ�����CO��N2������������CԪ�ػ��ϼ���+2������Ϊ+4�ۣ�NԪ�ػ��ϼ���-3������Ϊ0�ۣ�ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ����ݵ���ת���غ����n��Cl2�����ٸ���m=nM������Ҫ������������
����KCN�����ʵ�����ʹKCN��ȫת��Ϊ�����ʣ�����CO��N2������������CԪ�ػ��ϼ���+2������Ϊ+4�ۣ�NԪ�ػ��ϼ���-3������Ϊ0�ۣ�ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ����ݵ���ת���غ����n��Cl2�����ٸ���m=nM������Ҫ������������ Fe2O3��s��+CO��g��?
Fe2O3��s��+CO��g��? Fe��s��+CO2��g����ƽ�ⳣ������ʽk=
Fe��s��+CO2��g����ƽ�ⳣ������ʽk=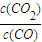 ��
��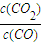 ������
������ Fe2O3��s��+CO��g��?
Fe2O3��s��+CO��g��? Fe��s��+CO2��g��
Fe��s��+CO2��g��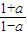 =4�����a=0.6��
=4�����a=0.6�� =0.006mol/��L?min����
=0.006mol/��L?min����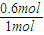 ×100%=60%��
×100%=60%��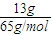 =0.2mol��ʹKCN��ȫת��Ϊ�����ʣ�Ӧ����CO��N2������������CԪ�ػ��ϼ���+2������Ϊ+4�ۣ�NԪ�ػ��ϼ���-3������Ϊ0�ۣ�ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ�����ת���غ��֪2×n��Cl2��=0.2mol×��4-2��+0.2mol×[0-��-3��]�����n��Cl2��=0.5mol������Ҫ����������Ϊ0.5mol×71g/mol=35.5g��
=0.2mol��ʹKCN��ȫת��Ϊ�����ʣ�Ӧ����CO��N2������������CԪ�ػ��ϼ���+2������Ϊ+4�ۣ�NԪ�ػ��ϼ���-3������Ϊ0�ۣ�ClԪ�ػ��ϼ���0�۽���Ϊ-1�ۣ�����ת���غ��֪2×n��Cl2��=0.2mol×��4-2��+0.2mol×[0-��-3��]�����n��Cl2��=0.5mol������Ҫ����������Ϊ0.5mol×71g/mol=35.5g��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�