
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.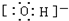 .
.分析 a是单核且含有10电子的微粒,则a是Ne;
b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;
c是双核10电子微粒,且带一个单位负电荷,则c是OH-;
d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;
e是单核带2个单位正电荷的10电子阳离子,则e是Mg2+;
f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O;
根据以上分析结合元素周期律知识进行解答.
解答 解:a是单核且含有10电子的微粒,则a是Ne;b是单核且带1个单位正电荷的离子,电子数为10,则b是Na+;c是双核10电子微粒,且带一个单位负电荷,则c是OH-;d是多核10电子分子,d是由共价键构成的四原子分子,则d是NH3;e是单核带2个单位正电荷的10电子阳离子,则e是Mg2+;f是多核带1个单位正电荷的10电子阳离子,g是多核分子且电子数为10的分子,c与f可形成两个共价型的g分子,则f是H3O+、g是H2O,
(1)a是Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为: ,
,
故答案为: ;
;
(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性强弱为:NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(3)D为氨气,氨水是若电解质存在电离平衡,电离生成铵根离子和氢氧根离子,电离方程式为:NH3•H2O?NH4++OH-;
故答案为:NH3•H2O?NH4++OH-;
(4)c为OH-,为带有1个单位负电荷的阴离子,其电子式为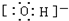 ,
,
故答案为: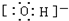 ;
;
(5)b为钠离子,其对应单质为钠,g为水,钠与水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,注意掌握原子结构与元素周期律、元素周期表的关系明确常见化学用语的概念及表示方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的种类由原子的质量数决定 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素所形成的所有含氧酸的酸性从左到右一定依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
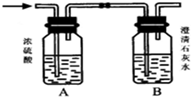 如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
如图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:| ① | ② | ③ | ④ | ⑤ |
| . | . |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
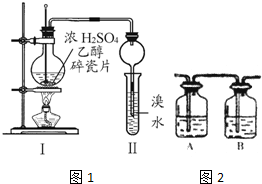 某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色)
某化学兴趣小组用如图所示装置进行探究性实验,验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变成棕黑色(棕黑色是浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com