【答案】
分析:(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到;
(2)①由图可知,到达平衡后,温度越高,φ(CH
3OH)越小,平衡向逆反应进行;
②利用三段式求出反应混合物的浓度变化量、平衡时各组分的浓度.
A.再充入1mol CO
2和3mol H
2,可等效为开始体积变为原来的2倍,加入2mol CO
2和6mol H
2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大;
B.利用v=

计算v(H
2)判断;
C.根据转化率的定义计算判断;
D.该温度下该反应的K=

,代入数据计算;
E.该反应为放热反应,升高温度平衡向逆反应进行,n(CH
3OH)减小,n(CO
2)增大.
③本质为2CH
3OH+3O
2=2CO
2+4H
2O,CH
3OH 失电子发生氧化反应,氧气得电子发生还原反应;正极上氧气得电子和氢离子反应生成水;
(3)根据反应物和生成物结合守恒的方法书写化学方程式;
(4)铵根离子水解呈酸性,从溶液电中性的角度分析.
解答:解:(1)已知:CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H
1=-574kJ?mol
-1 ,
CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H
2=-1160kJ?mol
-1,
不管化学反应是一步完成还是分几步完成,其反应热是相同的.利用盖斯定律将两式相加,可得
2CH
4(g)+4NO
2(g)=2N
2(g)+2CO
2(g)+4H
2O(g)△H=-1734 kJ/mol,
即CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g)△H=-867 kJ?mol
-1,
故答案为:CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g)△H=-867 kJ/mol;
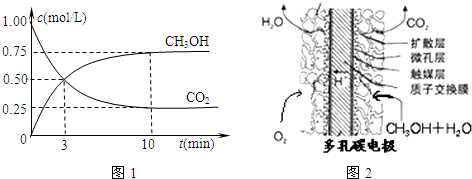
(2)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH
3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H
3<0,故答案为:<;
②由图可知,开始二氧化碳的浓度为1.0mol/L,开始容器中充入1mol CO
2和3mol H
2,所以开始氢气的浓度为3.0mol/L,容器体积为

=1L.
平衡时,甲醇的浓度为0.75mol/L
CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
A、通过上述计算可知二氧化碳的转化率为

×100%=75%,再充入1mol CO
2和3mol H
2,可等效为开始体积变为原来的2倍,加入2mol CO
2和6mol H
2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH
3OH)>1.5mol/L,故A错误;
B、10分钟内,氢气的平均反应速率为v(H
2)=

=0.225mol/(L?min),故B错误;
C、通过上述计算可知氢气的转化率为

×100%=75%,故C正确;
D、该温度下该反应的K=

=

=

,故D错误;
E、该反应为放热反应,升高温度平衡向逆反应进行,n(CH
3OH)减小,n(CO
2)增大,所以n(CH
3OH)/n(CO
2)值减小,故E正确.
故答案为:CE;
③正极发生还原反应,氧气得电子和氢离子反应生成水,电极反应式为O
2+4e
-+4H
+=2H
2O,故答案为:O
2+4e
-+4H
+=2H
2O;
(3)烟气中的SO
2、NO
2的物质的量之比为1:1,一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.则有12NH
3+3O
2+4SO
2+4NO
2+6H
2O=4(NH
4)
2SO
4+4NH
4NO
3,
故答案为:12NH
3+3O
2+4SO
2+4NO
2+6H
2O=4(NH
4)
2SO
4+4NH
4NO
3;
(4)硫酸铵和硝酸铵都为强酸弱碱盐,溶液中发生:NH
4++H
2O

NH
3?H
2O+H
+,所以溶液呈酸性,
在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,反应后溶液呈中性,溶液中存在:
c(Na
+)+c(H
+)+c(NH
4+)=c(NO
3-)+c(OH
-),则有c(Na
+)+c(H
+)<c(NO
3-)+c(OH
-),
故答案为:NH
4++H
2O

NH
3?H
2O+H
+;<.
点评:本题从多个角度对化石燃料进行了全面的考查,难度中等,培养了学生分析问题解决问题的能力,答题时注意电极反应式的书写方法,注意把握从守恒的角度书写化学方程式以及处理溶液离子浓度问题.



 计算v(H2)判断;
计算v(H2)判断; ,代入数据计算;
,代入数据计算; =1L.
=1L. CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ×100%=75%,再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH3OH)>1.5mol/L,故A错误;
×100%=75%,再充入1mol CO2和3mol H2,可等效为开始体积变为原来的2倍,加入2mol CO2和6mol H2,平衡后,再将体积压缩为原来的体积,增大压强平衡向体积减小的方向移动,即向正反应移动,反应物的转化率增大,所以再次达到平衡时c(CH3OH)>1.5mol/L,故A错误; =0.225mol/(L?min),故B错误;
=0.225mol/(L?min),故B错误; ×100%=75%,故C正确;
×100%=75%,故C正确; =
= =
= ,故D错误;
,故D错误; NH3?H2O+H+,所以溶液呈酸性,
NH3?H2O+H+,所以溶液呈酸性, NH3?H2O+H+;<.
NH3?H2O+H+;<.

 阅读快车系列答案
阅读快车系列答案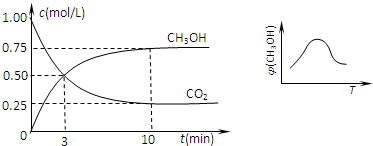 (2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.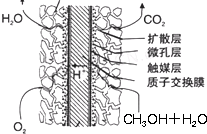
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+