
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱。常温下,向200mL0.10mol/L的甲胺溶液中滴加V mL.0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
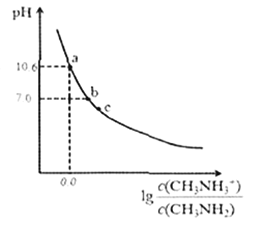
A. b点对应加入盐酸的体积V< 20.00mL
B. 甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 常温下,甲胺的电离常数为Kb,则pKb=-1gKb=4.3
D. c点可能存在关系: 2c(H+)+ c(CH3NH3+)=c(CH3NH2) +2c(OH- )+ c(Cl-)
【答案】C
【解析】甲胺的物质的量为:![]() 。A、当加入盐酸20.00mL时,HCl物质的量为:
。A、当加入盐酸20.00mL时,HCl物质的量为:![]() ,二者恰好完全反应生成CH3NH3+Cl- ,这是一种强酸弱碱盐,由于CH3NH3+水解溶液呈酸性,因此当盐酸适量减少时,溶液可以呈中性,所以b点pH=7的溶液,加入的HCl体积V<20.00 mL,A正确。B、甲胺的结构类似于氨气NH3,所以甲胺在水中的电离方程式为:CH3NH2+H2O
,二者恰好完全反应生成CH3NH3+Cl- ,这是一种强酸弱碱盐,由于CH3NH3+水解溶液呈酸性,因此当盐酸适量减少时,溶液可以呈中性,所以b点pH=7的溶液,加入的HCl体积V<20.00 mL,A正确。B、甲胺的结构类似于氨气NH3,所以甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-,B正确。C、根据B甲胺的电离方程式,
CH3NH3++OH-,B正确。C、根据B甲胺的电离方程式,![]() ,读图可得,当
,读图可得,当![]() 时,pH=10.6,即
时,pH=10.6,即![]() 时,c(H+)=10-10.6,所以Kb= c(OH-)=10-(14-10.6)=10-3.4,pKb=-lgKb=-lg10-3.4=3.4,C错误。D、c点pH<7,溶液呈酸性,所以可能是A提到的消耗20mL盐酸时得到的CH3NH3Cl溶液,根据电荷守恒则有c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),既2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(Cl-),且溶液中的Cl原子数与N原子数相等,所以c(Cl-)=c(CH3NH3+)+c(CH3NH2),代入上述后一个等式得:2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(CH3NH3+)+c(CH3NH2),化简得到:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),D正确。所以错误的答案选择C。
时,c(H+)=10-10.6,所以Kb= c(OH-)=10-(14-10.6)=10-3.4,pKb=-lgKb=-lg10-3.4=3.4,C错误。D、c点pH<7,溶液呈酸性,所以可能是A提到的消耗20mL盐酸时得到的CH3NH3Cl溶液,根据电荷守恒则有c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),既2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(Cl-),且溶液中的Cl原子数与N原子数相等,所以c(Cl-)=c(CH3NH3+)+c(CH3NH2),代入上述后一个等式得:2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(CH3NH3+)+c(CH3NH2),化简得到:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),D正确。所以错误的答案选择C。


科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的位置如下表所示.下列说法正确的是( ) 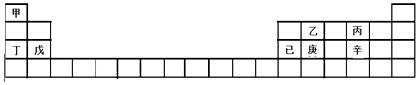
A.甲、丁、戊的单质都是金属
B.乙、丙、辛都是非金属元素
C.乙、庚、辛都能形成氧化物
D.已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() 可表示为
可表示为
A. ![]() =0.010mol/(L·s) B.
=0.010mol/(L·s) B. ![]() =0.0010 mol/(L·s)
=0.0010 mol/(L·s)
C. ![]() =0.0010 mol/(L·s) D.
=0.0010 mol/(L·s) D. ![]() =0.0045 mol/(L·s)
=0.0045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
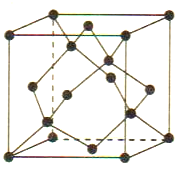
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K= ![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.该反应可表示为X(g)+2Y(g)═2Z(g)+2W(g)
B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C.增大反应容器的压强,该反应速率一定增大
D.升高温度,W(g)体积分数增加,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的叙述正确的是( )
A.甲烷不能使高锰酸钾酸性溶液褪色,所以甲烷不能发生氧化反应
B.甲烷与氯气的取代反应,生成的产物中CH3Cl最多
C.CH4的键角均为10928,可以说明甲烷分子是以碳原子为中心的正四面体结构,而不是平面正方形结构
D.甲烷、乙烷、丙烷是同系物,它们中的化学键都是极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3﹣和CO32﹣存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( ) 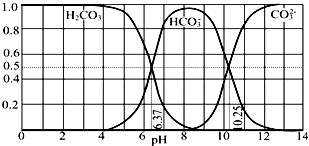
A.pH=10.25时,c(Na+)═c(CO32﹣)+c(HCO3﹣)
B.为获得尽可能纯的NaHCO3 , 宜控制溶液的pH为7~9之间
C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10﹣6.37
D.若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有H、N、O、Na、Cl、Fe、Cu七种常见元素,回答下列问题:
(1)Cl位于周期表第____周期____族。
(2)Na+离子的结构示意图为____。
(3)能说明非金属性Cl比N强的事实是____(用方程式表示)。
(4)A~L是由上述七种元素中的一种、二种或三种组成,A的摩尔质量为166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E属同类物质,E呈红褐色。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。它们有如下图所示的关系(部分反应条件及产物已略去):
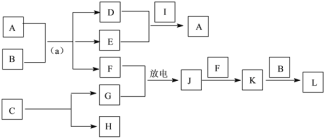
①C的化学式为____。
②D的电子式为____。
③L的稀溶液与H反应的离子方程式为____。
④反应(a)的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com