
| A. | O2 | B. | N2 | C. | CO2 | D. | NH3 |
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | MnO2 | B. | KClO3 | C. | KMnO4 | D. | K2Cr2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
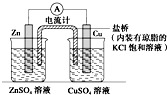
| A. | 该装置中电子由Zn极流向Cu极,CuSO4溶液中的SO41-通过盐桥移向Zn极 | |
| B. | 若装置中的两烧杯中均为CuSO4溶液,则电流计的指针偏转幅度变小,且很快减弱 | |
| C. | 将装置中烧杯内的溶液对换,电流计的指针也能发生偏转 | |
| D. | 将盐桥改为铜导线连接两种溶液,电流方向为由Cu极到Zn极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
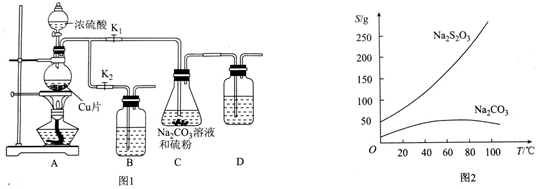
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和乙酸 | |
| B. | 将甲烷通入氯水中生成一氯甲烷 | |
| C. | 在苯中滴入稀硝酸制硝基苯 | |
| D. | 用食醋浸泡有水垢的水壶清除其中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 相同条件下,单质的密度逐渐变小 | D. | 单质的颜色逐渐加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com