
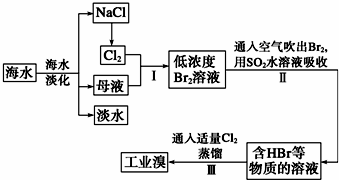
分析 海水淡化得到氯化钠,电极氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到韩HBr和的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,
步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的;生成物中溴的化合价分别为+5和-1价,在酸性条件下可发生归中反应生成溴,根据电子得失守恒配平;
解答 解:操作Ⅱ是二氧化硫吸收溴单质发生反应生成硫酸和溴化氢,使溴蒸气转化为氢溴酸以达到富集的目的.其反应离子方程式为:SO2+Br2+2H2O═SO42-+2Br-+4H+,
用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中发生反应是在酸性条件下可归中反应生成溴,反应的方程式为:BrO3-+5Br-+6H+=3Br2+3H2O
故答案为:SO2+Br2+2H2O═SO42-+2Br-+4H+;BrO3-+5Br-+6H+=3Br2+3H2O;
点评 本题主要考查海水提溴的原理,侧重于学生的分析能力、实验能力和元素化合物知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com