
| A. | 该氧化物是含有非极性键的离子化合物 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该晶体晶胞结构与CsCl相似 | |
| D. | 晶体中Ba2+的配位数为8 |
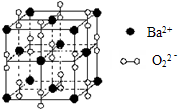
分析 晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×$\frac{1}{4}$+1=4,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2,
A、该物质为活泼金属和活泼非金属形成的化合物,应为离子化合物,含有O-O,为非极性键;
B、晶体的化学式为BaO2;
C、由晶胞结构可知,离子配位数为6,与NaCl结构相似;
D、利用均摊法计算,晶体中每个K+同时吸引着阴离子的数目为8×3×$\frac{1}{4}$=6.
解答 解:晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×$\frac{1}{4}$+1=4,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2,
A、该物质为活泼金属和活泼非金属形成的化合物,应为离子化合物,含有O-O,为非极性键,为含有非极性键的离子化合物,故A正确;
B、由以上分析可知晶体的化学式为BaO2,故B错误;
C、由晶胞结构可知,离子配位数为6,与NaCl结构相似,故C错误;
D、晶体中位于顶点的Ba2+离子和位于边上的阴离子距离最近,每个顶点为8个晶胞所共有,而每个边为4个晶胞共有,每个晶胞中有3个边上的阴离子距离相等且最近,根据均摊法计算,晶体中每个Ba2+同时吸引着阴离子的数目为8×3×$\frac{1}{4}$=6,故D错误.
故选:A.
点评 本题考查晶胞的结构和计算,题目具有一定难度,做题时注意利用均摊法计算.


科目:高中化学 来源: 题型:解答题
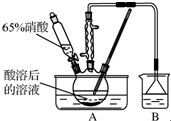 亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下: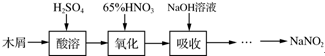
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| B. | a极是负极 | |
| C. | 电子由a通过灯泡流向b | |
| D. | 通入的气体Y为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金材料中可能含有非金属元素 | |
| B. | 光导纤维的主要成分是二氧化硅 | |
| C. | 金属氧化物均为碱性氧化物 | |
| D. | 不需要通过化学反应就能从海水中获得食盐和淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇有还原性 | B. | 乙醇发生了加成反应 | ||
| C. | 乙醇密度比水小 | D. | 乙醇是烃的含氧化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl固体中含有共价键 | |
| B. | CO2分子中含有离子键 | |
| C. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳的三种核素 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com