
科目:高中化学 来源:专项题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:专项题 题型:不定项选择题
| 下列各组实验中,反应速率最快的是(已知:H2SO4+Na2S2O3==Na2SO4+S↓+SO2↑+H2O) |
| [ ] |
| 反应温度 /℃ Na2S2O3体积/mL浓度/ mol·L-1 H2SO4体积/mL浓度/ mol·L-1 H2O的体积/mL A. 10 5 0.1 10 0.1 5 B. 10 5 0.1 5 0.1 10 C. 30 5 0.1 5 0.1 10 D. 30 5 0.2 5 0.1 10 |
查看答案和解析>>
科目:高中化学 来源:河南省模拟题 题型:单选题
查看答案和解析>>
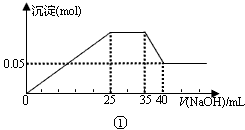
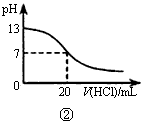
科目:高中化学 来源:0104 模拟题 题型:单选题

 2NH3(g)反应过程的能量变化。若使用催化剂,B点会升高
2NH3(g)反应过程的能量变化。若使用催化剂,B点会升高 查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
 ,下列条件能加快其反应速率的是
,下列条件能加快其反应速率的是查看答案和解析>>
科目:高中化学 来源:同步题 题型:不定项选择题
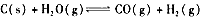 ,下列条件的改变对化学反应速率几乎无影响的是
,下列条件的改变对化学反应速率几乎无影响的是 查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
 2Fe2O3+8 SO2,为了提高SO2的生成速率,下列措施可行的是
2Fe2O3+8 SO2,为了提高SO2的生成速率,下列措施可行的是查看答案和解析>>
科目:高中化学 来源:0103 期中题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com