
| A. | 该物质中一定只含钠元素 | B. | 该物质一定含钠元素,没有钾元素 | ||
| C. | 不能确定该物质中是否含钾元素 | D. | 该物质一定是金属钠 |
分析 根据焰色反应是元素的性质与元素的存在形态无关,可能是含钠化合物,也可能是单质,钾元素的焰色反应为紫色,易被黄光遮住,据此来分析解答.
解答 解:A、焰色反应的性质是元素的性质,与元素的存在形态无关,可能是含钠化合物,也可能是单质,某物质灼烧时,焰色反应为黄色,该物质中一定含钠元素,但不一定只含钠元素,故A错误;
B、焰色反应的性质是元素的性质,物质灼烧时,焰色反应为黄色,则一定含有钠元素,钾元素不能确定,灼烧时透过蓝色钴玻璃看到火焰呈紫色,说明溶液中说明该物质中一定含有钾元素,故B错误;
C、灼烧时透过蓝色钴玻璃看到火焰呈紫色,说明溶液中说明该物质中一定含有钾元素,某物质灼烧时,焰色反应为黄色,不能确定该物质中是否含钾元素,故C正确;
D、焰色反应的性质是元素的性质,与元素的存在形态无关,可能是含钠化合物,也可能是单质,故D错误;
故选C
点评 本题考查焰色反应,高中阶段要求掌握两种元素--Na、K的焰色,明确焰色反应是元素的性质是解答的关键,注意掌握各种元素的焰色反应的颜色和观察方法,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
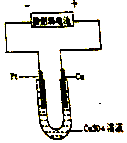 肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 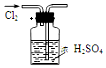 干燥Cl2 | B. |  吸收HCl | ||
| C. |  用自来水制蒸馏水 | D. |  吸收NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的分子数目之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物一定是酸性氧化物 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 分子中含有几个氢原子就是几元酸 | |
| D. | 酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com