
| A. | 铁屑与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 氢氧化铝溶于稀硝酸:OH-+H+=H2O | |
| D. | 硫酸铁与氢氧化钡反应:Ba2++SO42-=BaSO4↓ |
分析 A.不符合反应客观事实;
B.二者反应生成硫酸钡和水;
C.氢氧化铝为沉淀,应保留化学式;
D.漏掉氢氧根离子与三价铁离子的反应.
解答 解:A.铁屑与稀盐酸反应,离子方程式:Fe+2H+=Fe2++H2↑,故A错误;
B.稀硫酸与氢氧化钡溶液反应,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B正确;
C.氢氧化铝溶于稀硝酸,离子方程式:Al(OH)3+3H+=3H2O+Al3+,故C错误;
D.硫酸铁与氢氧化钡反应,离子方程式:2Fe3++6OH-+3Ba2++3SO42-=3BaSO4↓+2Fe(OH)3↓,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
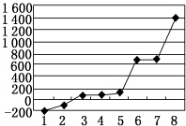
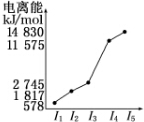
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子化合物极难溶解 | |
| B. | 高分子化合物依靠分子间作用力结合,材料强度较小 | |
| C. | 高分子均为长链状分子 | |
| D. | 高分子材料均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2+3H2?2NH3△H=-38.6kJ•mol-1 | |
| B. | 已知在105Pa,298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,则其热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| C. | 甲烷的标准燃烧热数值为890.3kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| D. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1mol水时放出的热量为57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能溶于浓盐酸或浓硝酸中 | |
| B. | 都能溶于氢氧化钠溶液中 | |
| C. | 它们的熔点都很高,常用做耐火材料 | |
| D. | 常温下都不能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10 NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA | |
| D. | 常温常压下,22.4L乙烯中C--H键数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com