
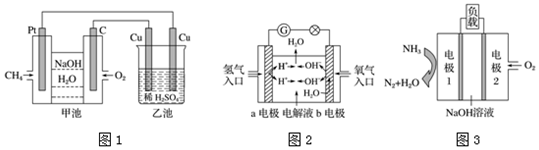
分析 (1)甲池能自发的发生氧化还原反应为原电池,乙池有外接电源属于电解池,甲池中甲烷失电子作负极,氧气作正极,则连接负极的铜棒是阴极,连接正极的铜棒是阳极,根据原电池和电解池的电极反应,结合选项分析;
(2)燃料电池中燃料氢气在负极失电子发生氧化反应,氧气在正极上得到电子发生还原反应;
(3)a、原电池中的阳离子向正极移动;
b、原电池中,电子是从负极流向正极;
c、燃料电池的总反应是燃料燃烧的化学方程式;
d、在燃料电池的负极上发生燃料失电子的氧化反应,在正极上氧气发生得电子的还原反应;
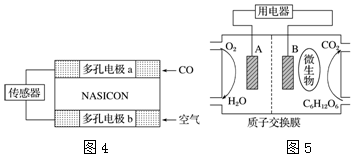
(4)本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极;
(5)葡萄糖为燃料的微生物燃料电池,A极通氧气为生物燃料电池的正极;负极是葡萄糖失电子生成二氧化碳;
解答 解:(1)a、甲池中通甲烷的极是负极,原电池中阳离子向正极移动,即Na+向C电极移动,故a错误;
b、C电极为正极,正极上氧气得电子生成氢氧根离子,则其电极反应为:O2+4e-+2H2O═4OH-,故b错误;
c、乙池有外接电源属于电解池,其电池反应为:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$H2↑+CuSO4,故c正确;
d、甲装置中反应生成水,溶液碱性减弱,则PH减小,乙装置中消耗硫酸,溶液的pH都逐渐增大,故d错误;
故选c;
(2)a、b两个电极均由多孔的碳块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电,是氢氧燃料电池,燃料氢气在a电极负极失电子发生氧化反应,电极反应式为H2-2e-═2H+;
故答案为:H2-2e-═2H+;
(3)根据电池的工作原理示意图,知道通氧气的电极2是正极,电极1是负极;
a、原电池工作时,电解质中的阳离子向正极移动,即Na+向正极移动,故a错误;
b、原电池中,电子是从负极电极1流向正极电极2,故b错误;
c、燃料电池的总反应是燃料燃烧的化学方程式,即4NH3+3O2=2N2+6H2O,故c正确;
d、在燃料电池的负极上发生燃料氨气失电子的氧化反应,在正极电极2上是氧气发生得电子的还原反应,碱性环境下电极反应应该是:O2+4e-+2H2O=4OH-,故d错误.
故选c;
(4)本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极,b为正极,阴离子向负极移动,O2-由电极b流向电极a,负极电极反应式为:CO-2e-+O2-═CO2,故答案为:CO-2e-+O2-═CO2;
(5)葡萄糖为燃料的微生物燃料电池,A极通氧气为生物燃料电池的正极;负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故答案为:正;C6H12O6+6H2O-24e-=6CO2↑+24H+.
点评 本题考查了原电池原理和电解池原理的应用,明确电极上发生的反应及电极方程式的书写是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶于稀盐酸中 CO32-+2H+═CO2+H2O | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 碳酸氢钠溶液与盐酸反应 HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解MgCl2饱和溶液,可制得Cl2,但得不到镁 | |
| B. | 镁与稀盐酸反应剧烈,加入碳酸钠晶体可以减慢反应速率 | |
| C. | 电解饱和食盐水制氯气时用铁作阳极 | |
| D. | 电解法精炼粗铜,用纯铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400 | B. | 500 | C. | 4×10-4 | D. | 2.5×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物中一定不存在共价键 | B. | 在单质分子中一定存在共价键 | ||
| C. | 共价键一定只存在于共价化合物中 | D. | 在共价分子中一定存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,一定有一种元素被氧化,另一种元素被还原 | |
| B. | 物质所含元素的化合价越高,该物质的氧化性就越强 | |
| C. | HClO既有氧化性,又有还原性 | |
| D. | 1molCl2参加反应转移2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com