
 .
.分析 (1)盐酸的物质的量浓度=$\frac{10{\;}^{3}ρω}{M}$;
(2)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,根据Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,标出电子的转移方向和数目;
(3)化合价降低的元素所在的反应物是氧化剂,还原剂对应的产物是氧化产物;
(4)根据KMnO4和转移电子之间的关系式计算;
(5)根据方程式知,参加反应的HCl有$\frac{5}{8}$被氧化,由KMnO4和HCl之间的关系式计算;
解答 (15分)
解:(1)盐酸的物质的量浓度=$\frac{10{\;}^{3}ρω}{M}$=$\frac{10{\;}^{3}×1.2×36.5%}{36.5}$mol/L=12mol/L,故答案为:12mol/L;
(2)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,
故答案为: ;
;
(3)反应中锰元素化合价降低,锰元素所在的反应物KMnO4是氧化剂,氯化氢是还原剂,对应的产物是氧化产物,故答案为:KMnO4,Cl2;
(4)该反应中Mn元素化合价由+7价变为+2价,所以转移电子的物质的量=xmol×(7-2)=5xmol,故答案为:5xmol;
(5)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:$\frac{5}{8}$,15.8g (即0.1mol)KMnO4完全反应时,产生的Cl2为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L,消耗的HCl为0.8mol,被氧化的HCl为0.5mol,故答案为:5.6L;0.5.
点评 本题考查氧化还原反应的计算,明确方程式中各个物理量之间的关系式是解本题关键,侧重考查计算能力,注意参加反应的HCl有一部分被氧化,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | S(s)+O2(g)═SO2(g)△H=-269.8kJ/mol(反应热) | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.6 mol•L-1•min-1 | B. | v(B)=0.45 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(A)=0.2 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸根 | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
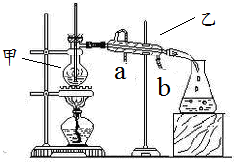 如图所示是分离某种混合物时实验装置,请完成下列问题:
如图所示是分离某种混合物时实验装置,请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消去→加成→水解 | B. | 加成→消去→取代 | C. | 消去→加成→消去 | D. | 取代→消去→加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线 | |
| B. | 用量筒量取所需的浓硫酸时仰视读数 | |
| C. | 定容时,俯视刻度线 | |
| D. | 用量筒量取浓硫酸倒入烧杯,再用蒸馏水洗量筒2~3次,洗液倒入烧杯中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com