
用石墨电极电解CuCl2溶液(见右图),下列分析正确的是

A.b端是直流电源的负极
B.用湿润的KI一淀粉试纸检验甲电极产物
C.通电一段时间后,在阴极附近观察到黄绿色气体
D.若将甲电极换成铁棒,乙电极换成铜棒,则可实现在铁棒上镀铜
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中文科化学试卷(解析版) 题型:选择题
下列关于食品添加剂的说法不正确的是
A.亚硝酸钠可以致癌
B.我们应该禁止使用防腐剂
C.苯甲酸钠可用作防腐剂
D.绝大多数食品添加剂在过量使用时对人体有害的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下期中化学试卷(解析版) 题型:选择题
烯烃或炔烃在酸性高锰酸钾溶液作用下,分子中的不饱和键完全断裂,此法可用于减短碳链或利用产物反推不饱和烃的结构等。已知烯烃与酸性 KMnO4溶液反应的氧化产物的对应关系为
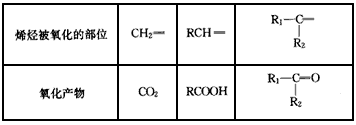
现有某烯烃与酸性KMnO4溶液作用后得到的氧化产物有CO2、乙二酸(HOOC-COOH)和丙酮 (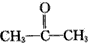 ),则该烯烃结构简式可能是
),则该烯烃结构简式可能是
A.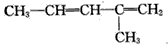
B.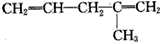
C. CH2=CH-CH=CHCH2CH3
D.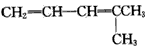
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:填空题
【选修3 :物质结构与性质】有A、B、C、D、E五种原子序数依次增大的元素(原子序数均不大于30)。A的基态原子2p能级有3个单电子;C的核外没有成单电子,B、C两元素形成的化合物晶胞结构如下图所示;D的3p能级有1个单电子,且与B所在主族相邻;E元素在地壳中含量居第四位;则:
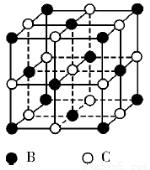
(1)写出基态E原子的价电子排布式 。
(2)A的最简单氢化物分子的空间构型为 ,其中A原子的杂化类型是 。
(3)B能形成两种常见的单质,其分子式分别为 ,其沸点是同族元素氢化物中最高的因是 。
(4)A和D形成的化合物中,D显正化合价,试写出该化合物与水反应的方程式: 。
(5)B、C两元素形成的化合物晶胞结构中,B原子是堆积_______(填堆积模型);已知B和C形成的化合物晶体的密度为ρg • cm-3,阿伏加德罗常数为 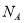 ,求晶胞边长a = cm。(用含
,求晶胞边长a = cm。(用含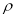 、
、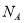 的计算式表示)
的计算式表示)
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如右图所示,则下列叙述正确的是
A.b、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c 点溶液中 c(H+ )=c(OH-)+c(CH3COOH)
D.用等浓度的盐酸分别与等体积的b)处溶液恰好完全反应,消耗盐酸体积 Vb=Vc
查看答案和解析>>
科目:高中化学 来源:2016届湖南省等四校高三联考化学试卷(解析版) 题型:选择题
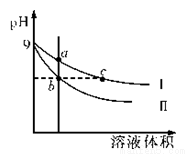
仅用下图装置可完成
A.浓硫酸和铜制SO2
B.用Cu与浓HNO3反应制NO2
C.用 NH4CI 与 Ca(OH)反应制 NH3
D.用锌粒与稀H2SO4反应制H2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:填空题
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大。W,Z同主族,可形成离子化合物ZW;Y , M同主族,可形成MY2, MY3两种分子;X的气态氢化物水溶液呈碱性。
请回答下列问题:
(1)Y在元素周期表中的位置为 ;
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是 (写化学式)
(3) W、Y、Z、G形成的简单离子的半径大小顺序是 (用化学符号表示)
(4)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (任写两个)
(5)Y与M的氢化物中,热稳定性差的是 (填化学式),沸点高的是 (填化学式)
(6)ZW的电子式为 ,W2Y2的电子式为 ,用电子式表示Z2M的形成过程: 。
(7)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,品红溶液 (填“褪色”或“不褪色”),请用相关离子方程式解释原因 。
(8)已知
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(9)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N入出942kJ。根据以上信息和数据,下列说法正确的是 。
A.N4属于一种新型化合物 B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2 D.1molN4转变为N2将吸收882kJ的能量.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一下期中化学试卷(解析版) 题型:选择题
元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法正确的是
A.第一主族的元素称为碱金属
B.第二周期元素的最高化合价依次递增,并等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数一定相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学高一下期中化学试卷(解析版) 题型:填空题
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 [
(2)地壳中含量最多的金属元素的名称是
(3)用电子式表示②与④形成化合物的过程 。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 (用化学式作答,下同),碱性最强的是 。
(5)写出⑤与氢氧化钠反应的化学方程式: 。写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是 ,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com