
 设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
设计了一个实验装置,也能使铜很快溶于稀盐酸.请在下面的方框中画出该装置:
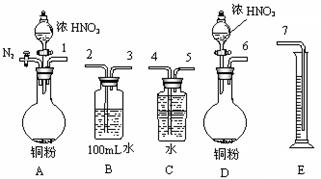
 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入铜片 | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入铜片 | 无明显变化 |
| Ⅲ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正极反应式为:O2 + 2H2O +4e- =4OH- |
| B.工作一段时间后,电解液中KOH的物质的量浓度不变 |
| C.该燃料电池的总反应式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.×100% | B.×100% | C.% | D.% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2+ + 2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
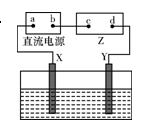
| A.接通电路后,水槽中溶液的pH不变 |
| B.b是正极,Y电极上发生氧化反应 |
| C.同温同压下,X、Y两电极上产生气体的体积相等 |
| D.d点显红色是因为接通电路后OH-向d点移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
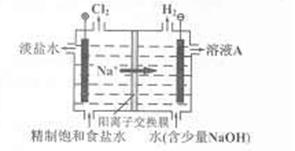
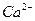 、
、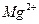 ,NH+3,
,NH+3,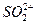 ,[
,[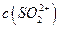 >
>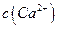 ]。
]。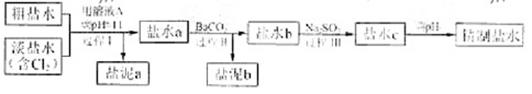
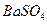 的溶解度比
的溶解度比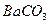 的小,过程Ⅱ中除去的离子有
的小,过程Ⅱ中除去的离子有 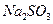 的含量小于5mg /l ,若盐水b中
的含量小于5mg /l ,若盐水b中 的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10%
的含量是7.45 mg /l ,则处理10m3盐水b ,至多添加10% 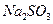 溶液 kg(溶液体积变化忽略不计)。
溶液 kg(溶液体积变化忽略不计)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com