
| A. | K>Na>Li | B. | Na+>Mg2+>O2- | C. | P>S>O | D. | Cl-<Br-<I- |
分析 A.同主族自上而下原子半径增大;
B.核外电子排布相同,核电荷数越大离子半径越小;
C.电子层数相同时,核电荷数越大离子半径越小;
D.电子层越多离子半径越大.
解答 解:A.K、Na、Li是同主族自下而上,故原子半径减小,故A正确;
B.Na+、Mg2+、O2-的核外电子排布相同,而当电子层数相同时,核电荷数越大离子半径越小,故有:Mg2+<Na+<O2-,故B错误;
C.O有2个电子层,而P、S均有三个电子层,电子层数越多,半径越大,故O的半径最小;而电子层数相同时,核电荷数越大离子半径越小,故S的半径小于P但大于O,故C正确;
D.Cl-、Br-、I-的电子层数逐渐增多,而电子层数越多,离子半径越大,故D正确.
故选B.
点评 本题考查微粒半径大小比较,难度中等,关键清楚微粒半径大小比较的规律.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色 | |
| C. | 对2HI(g)?H2(g)+I2(g)平衡体系增大压强使气体颜色变深 | |
| D. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4,反应转移的电子总数为4mol | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为1:5 | |
| C. | 3mol Fe2+被氧化时,消耗O2标准状况下的体积约为22.4L | |
| D. | x=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
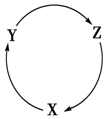 下列各组物质中,满足图中物质一步转化关系的选项是( )
下列各组物质中,满足图中物质一步转化关系的选项是( )| X | Y | Z | |
| A | CO | CO2 | H2CO3 |
| B | Cu | CuO | Cu(OH)2 |
| C | CaO | Ca(OH)2 | CaCO3 |
| D | H2SO4 | Na2SO4 | NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间的碰撞一定能发生化学反应 | |
| B. | 升高温度时,化学反应速率加快,主要原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 | |
| C. | 自发进行的反应一定迅速 | |
| D. | 凡是熵增加的过程都是自发过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑧⑩ | B. | 除③外 | C. | 除④外 | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
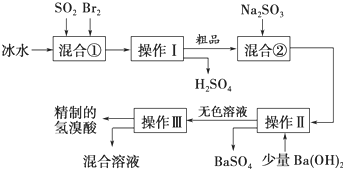
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com