
根据四种变化:①Fe(s)→Fe(g);②2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1;
③C(s)+CO2(g)=2CO(g);④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 (请填变化的代码①②③④,下同)。
⑵上述变化中,体系的混乱度增大的是 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 kJ的能量。
⑷下面几种说法中。正确的是 [
| A.化合反应都大多是放热反应 |
| B.凡是需要加热的反应,都是吸热反应 |
| C.体系的混乱度增大的反应都是吸热反应 |
| D.中和反应是放热反应,其化学能可以转化成电能 |
(1)①③④ (2)①③④ (3)498 (4)A
解析试题分析:(1)铁由固态变为气态是物理变化,但需要吸热,氢气燃烧是放热反应,碳与CO2反应生成CO的是吸热反应,氢氧化钠电离是吸热过程,所以需要吸收热量的是①③④。
(2)同一种物质在气态是熵值最大,氢气燃烧熵值减小,碳与CO2反应是体积增大的可逆反应,电离过程是熵值增大的,所以上述变化中,体系的混乱度增大的是①③④。
(3)反应热=反应物的键能-生成物的键能,所以根据2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1可知,2×436 kJ·mol-1+x-4×463 kJ·mol-1=-482 kJ·mol-1,解得x=498kJ·mol-1,即断裂1 molO2(g)中的共价键需要吸收498的能量。
(4)A、化合反应都大多是放热反应,A正确;B、反应是放热反应还是吸热反应与反应条件无关系,只与反应物总能量和生成物总能量的相对大小有关系,因此凡是需要加热的反应,都是吸热反应是错误的,B不正确;C、体系的混乱度增大的反应不一定都是吸热反应,C不正确;D、中和反应是放热反应,但不是氧化还原反应,因此其化学能不可以转化成电能,D不正确,答案选A。
考点:考查化学反应中的能量变化、反应热计算以及熵值判断等


科目:高中化学 来源: 题型:单选题
2013年6月11日我国成功发射了“神州十号”。这标志着中国人的太空时代又前进了一大步。发射“神十”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol |
| B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol |
| C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol |
| D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于化学反应中的能量变化,表述准确的是
| A.形成新化学键的过程会放出能量 | B.中和反应是吸热反应 |
| C.加热才能发生的反应是吸热反应 | D.生成CO2的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2013年10月世界卫生组织癌症专门机构首次指认大气污染“对人类致癌”。下列行为有利于防止大气污染、遏制雾霾天气发生的是
| A.在田间焚烧秸杆 |
| B.冬季燃烧大量烟煤供热取暖 |
| C.提倡开私家车出行,减少乘坐公交车 |
| D.改善能源结构,大力发展太阳能、风能等清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
| A.2CH4(g) + 4O2(g) =2CO2(g) + 4H2O(l) ΔH=+890kJ·mol-1 |
| B.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=+890kJ·mol-1 |
| C.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=-890kJ·mol-1 |
| D.1/2CH4(g) + O2(g) =1/2CO2(g) + H2O(l) ΔH=-890kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列推论正确的是:
| A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2 |
| B.C(石墨,s)=C(金刚石,S)△H="+1.9" kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下列各图的叙述,正确的是
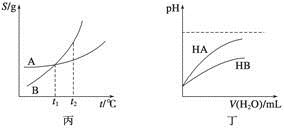
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44kJ的热量。其它相关数据如下表,则表中X为:
| | O=O(g) | H-H(g) | H-O(g) |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | X | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式或说法,正确的是( )
| A.甲烷的燃烧热为 890 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890 kJ·mol-1 |
B.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=-38.6 kJ·mol-1 2NH3(g);ΔH=-38.6 kJ·mol-1 |
| C.已知:H2(g)+F2(g)=2HF(g);ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com