
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 含钴废料中加入盐酸、Na2SO3,可得CoCl2、AlCl3、FeCl2,加入NaClO3,发生氧化还原反应可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干.
(1)酸性条件下,Co2O3和SO32-发生氧化还原反应生成Co2+、SO42-;
(2)酸性条件下,氯酸根离子能氧化亚铁离子生成铁离子,自身被还原生成氯离子;酸性条件下ClO3-和Cl-发生氧化还原反应生成Cl2;
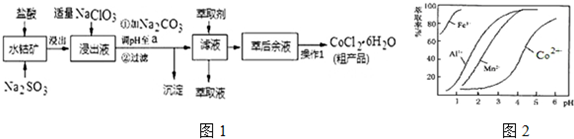
(3)“加Na2CO3调pH至a”,目的是除去铁离子、铝离子,所以需要将铁离子、铝离子转化为沉淀;
(4)CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴;
(5)滤液中加入萃取剂的作用是除去锰离子,由表中数据可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(6)根据CoCl2•6H2O的组成分析,可能是含有杂质,也可能是失去部分水.
解答 解:含钴废料中加入盐酸、Na2SO3,可得CoCl2、AlCl3、FeCl2,加入NaClO3,发生氧化还原反应可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干.
(1)酸性条件下,Co2O3和SO32-发生氧化还原反应生成Co2+、SO42-,反应离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)酸性条件下,氯酸根离子能氧化亚铁离子生成铁离子,自身被还原生成氯离子,反应离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,酸性条件下ClO3-和Cl-发生氧化还原反应生成Cl2,反应离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)“加Na2CO3调pH至a”,目的是除去铁离子、铝离子,将铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,过滤除去,
故答案为:Fe(OH)3、Al(OH)3;
(4)CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴,减压烘干目的是:降低烘干温度,防止产品分解
故答案为:降低烘干温度,防止产品分解;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子,由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(6)造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:粗产品含有可溶性氯化物或晶体失去了部分结晶水,导致相同质量的固体中氯离子含量变大,
故答案为:粗产品含有可溶性氯化物或晶体失去了部分结晶水.
点评 本题属于化学工艺流程题目,涉及物质分离和提纯、对操作与药品的分析评价、元素化合物知识、含量测定误差分析、信息获取与迁移运用等,关键是理解工艺流程,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH溶液产生红褐色沉淀,则原溶液中一定有FeCl3 | |
| B. | 加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定是CO32-或SO32- | |
| C. | 先通入少量Cl2后,再加入淀粉溶液后,溶液变蓝,说明有I- | |
| D. | 往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者燃烧时现象完全相同 | |
| B. | 点燃前都不需要验纯 | |
| C. | 甲烷燃烧火焰呈淡蓝色,乙烯燃烧火焰较明亮 | |
| D. | 二者燃烧时都有黑烟生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往Na[Al(OH)4]溶液中通入过量CO22[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O | |
| B. | Na2SiO3溶液与稀醋酸混合SiO32-+2H+=H2SiO3↓ | |
| C. | 钠与CuSO4溶液反应2Na+Cu2+=Cu+2Na+ | |
| D. | 往Na2SO3溶液中滴加双氧水 H2O2+SO32-=SO42-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选用的仪器 | |||||
| 添加的药品(或必要的操作) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应 | B. | ①②均属于氧化还原反应 | ||
| C. | 每消耗1mol TiO2会生成56g CO | D. | 反应②中镁元素化合价升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com