
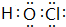 ,
,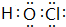 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、CH3CHO+2Cu(OH)2
| |||
B、CH3CH2OH+CuO
| |||
C、2CH2═CH2+O2
| |||
| D、CH3CH2OH+HBr-→CH3CH2Br+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液和醋酸的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、KOH溶液和盐酸反应 |
| D、NaHCO3和NaOH的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,测0.1mol/L的HX溶液的pH,若pH>1,证明HX是弱酸 |
| B、室温下,测0.1mol/L的NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C、相同条件下,对0.1mol/L的HCl和0.1mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX是弱酸 |
| D、将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离的c(H+):①=②=③=④ |
| B、将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4溶液中:K+、H+、Cl-、NO3- |
| B、c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- |
| C、使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2- |
| D、和铝反应产生氢气的溶液中:K+、Ba2+、NO3-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com