
| A�� | ����BaCl2��Һ�����������ɫ��������һ������SO${\;}_{4}^{2-}$ | |
| B�� | ����Һ�м������ữ��BaCl2�����������ɫ��������һ����SO${\;}_{4}^{2-}$ | |
| C�� | �ȼ������ᣬ�������������ټ���Ba��NO3��2��Һ����������ɫ����������SO${\;}_{4}^{2-}$ | |
| D�� | �ȼ������ᣬ�������������ټ���BaCl2��Һ����������ɫ����������SO${\;}_{4}^{2-}$ |
���� A����������ӡ�����������ӡ������Ӻ��Ȼ���֮�䷴Ӧ��������ְ�ɫ������
B������Һ�м������ữ��BaCl2��������ɫ�����������Ȼ��������ᱵ��
C�����������������������ӵ���Һ���ȼ������ᣬ�����������ټ���Ba��NO3��2��Һ��������ɫ������
D����������ӿ��Ժͱ�����֮�䷴Ӧ���ɰ�ɫ����������ij�����
��� �⣺A����������ӡ�����������ӡ������Ӻ��Ȼ���֮�䷴Ӧ��������ְ�ɫ����������BaCl2��Һ�����������ɫ��������һ��������������ӡ�����������ӡ��������е�һ�֣���A����
B������Һ�м������ữ��BaCl2��������ɫ�����������Ȼ��������ᱵ������Һ�м������ữ��BaCl2�����������ɫ��������һ���������ӻ�������������е�һ�֣���B����
C���ȼ������ᣬ�������������ټ���Ba��NO3��2��Һ����������ɫ���������к����������������������е�һ�֣���C����
D����������ӿ��Ժͱ�����֮�䷴Ӧ���ɰ�ɫ����������ij������ȼ������ᣬ�������������ų������ӣ�̼���������������ӵĴ��ڣ��ټ���BaCl2��Һ����������ɫ������������������ӣ���D��ȷ��
��ѡD��
���� ���⿼��ѧ�����ӵļ����Լ����ӵ��������ӷ�Ӧ�����֪ʶ�������ۺ�֪ʶ�Ŀ��飬�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʯ�ҿɴ������Է�ˮ | B�� | ��������Ǧ�Ͻ��۵�Ƚ������� | ||
| C�� | �ö����ЧӦ��������Һ�ͽ��� | D�� | ���ȵĴ�����Һ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ʼŨ�� | �� | �� | �� |
| c��H2/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c��I2��/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A�� | ƽ��ʱ���кͱ���H2��ת������ͬ | |
| B�� | ƽ��ʱ����I2��ת����С��40% | |
| C�� | ƽ��ʱ����c��HI���ȼ��е�2���� | |
| D�� | ��Ӧƽ��ʱ������������ɫ�������������ɫ��dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̬ | B�� | Һ̬ | C�� | ��̬ | D�� | ��ˮ����̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ʒ���ڲ�ʹ��Ҳ���ϻ� | |
| B�� | ����ͨ��������Ļ���ʵ�����̼���ƺ�̼������ | |
| C�� | �������ƿ����������������ԺͶ�������Ӧ�����������ƺ����� | |
| D�� | ������ Na2C03��С�մ��� NaHC03����ˮ��Һ���ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
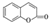 ����һ��Ӧ�ù㷺�����Ϻ�ҩ���м��壮�Լױ�Ϊԭ�������㶹���������£�
����һ��Ӧ�ù㷺�����Ϻ�ҩ���м��壮�Լױ�Ϊԭ�������㶹���������£�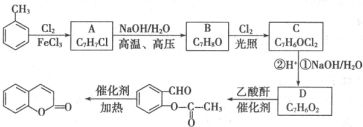
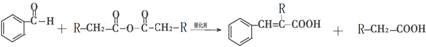
 ��D�Ľṹ��ʽ��
��D�Ľṹ��ʽ��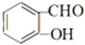 ��
��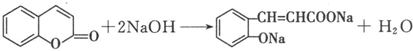 ��
�� ��
��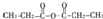 ��ͨ����Ӧ��ͷ�Ӧ�õ����㻯����E��E�Ľṹ��ʽ��
��ͨ����Ӧ��ͷ�Ӧ�õ����㻯����E��E�Ľṹ��ʽ��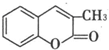 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -44.2kJ/mol | B�� | +44.2kJ/mol | C�� | -330kJ/mol | D�� | +330kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com