
| A | B | |
| C | D |
分析 由短周期元素A、B、C、D在周期表中的位置可知,A、B处于第二周期,C、D处于第三周期,B、D同种主族,B、D最外层电子数之和为12,故最外层电子数为6,故B为O元素,D为S元素,二者可以形成SO2、SO3两种分子,且SO2具有漂白性,由位置关系可知,A为N元素,C为Si元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数,A为N元素,其氢化物为NH3;
(2)a.非金属性越强,氢化物越稳定;
b.非金属性越强,阴离子的还原性越弱;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
d.氧元素一般没有正化合价;
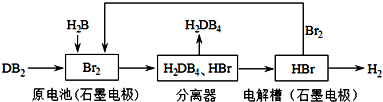
(3)由工艺流程图可知,原电池原理为SO2+Br2+2H2O=H2SO4+2HBr,分离出硫酸,再电解:2HBr$\frac{\underline{\;电解\;}}{\;}$H2↑+Br2,获得氢气,电解得到的溴循环利用.
①在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4;根据SO2+Br2+2H2O=H2SO4+2HBr、2HBr$\frac{\underline{\;电解\;}}{\;}$H2↑+Br2计算生成氢气体积;
②分离完全,硫酸中不含HBr,加入AgNO3溶液,根据沉淀颜色判断;
③原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,两式相加可得该工艺流程用总反应的化学方程式.
解答 解:由短周期元素A、B、C、D在周期表中的位置可知,A、B处于第二周期,C、D处于第三周期,B、D同种主族,B、D最外层电子数之和为12,故最外层电子数为6,故B为O元素,D为S元素,二者可以形成SO2、SO3两种分子,且SO2具有漂白性,由位置关系可知,A为N元素,C为Si元素,
(1)A为N元素,处于第二周期VA族,其氢化物为NH3,故答案为:二、VA;NH3;
(2)a.非金属性N>Si,故氢化物稳定性NH3>SiH4,故a正确;
b.非金属性O>S,非金属性越强,阴离子的还原性越弱,故还原性O2-<S2-,故b错误;
C.非金属性S>Si,故酸性:H4SiO4<H2SO4,故c错误;
d.氧元素一般没有正化合价,故d错误;
故答案为:a;
(3)由工艺流程图可知,原电池原理为SO2+Br2+2H2O=H2SO4+2HBr,分离出硫酸,再电解:2HBr$\frac{\underline{\;电解\;}}{\;}$H2↑+Br2,获得氢气,电解得到的溴循环利用.
①在原电池中,负极发生氧化反应,SO2在负极放电生成H2SO4,电极反应式为SO2+2H2O-2e-=4H++SO42-,根据SO2+Br2+2H2O=H2SO4+2HBr、2HBr$\frac{\underline{\;电解\;}}{\;}$H2↑+Br2可得关系式:SO2~H2,若有5mol SO2参加反应(假若反应物无损耗),则生成标准状况下H2体积为5mol×22.4L/mol=112L,
故答案为:负极;SO2+2H2O-2e-=4H++SO42-;112;
②分离后的H2SO4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,故该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2SO4+H2,
故答案为:SO2+2H2O=H2SO4+H2.
点评 本题综合较大,涉及结构性质位置关系、元素周期律、化学工艺流程、原电池及电解原理等,侧重于学生的分析能力的考查,是对知识的综合考查,注意基础知识的全面掌握.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 在测定中和反应的反应热实验中,只要读一次温度 | |
| B. | 可用pH试纸测定新制氯水的pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向CH3COONa溶液中滴入石蕊试液,溶液变蓝 | |
| E. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| C. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| D. | 中性透明溶液:K+、Cl-、NO3-、Fe3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中,Fe3+、Cl-、Na+、NO3- | |
| B. | 水电离出的[H+]=1×10-3mol/L 的溶液中Na+、CO32-、Cl-、K+ | |
| C. | pH=1的溶液中NH4+、Cl-、Mg2+、SO42-、 | |
| D. | Al3+、HCO3-、I-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
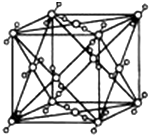 已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E都是周期表中的前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外层电子层的P能级(轨道)上的电子处于半充满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一类半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 煤、石油中的硫元素燃烧时能生成SO2 | |
| B. | 动物尸体腐败过程产生的H2S气体会进入大气 | |
| C. | 循环过程中硫元素既发生氧化反应又发生还原反应 | |
| D. | 大气中的硫元素会全部转化成H2SO4随雨水降到土壤里 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.6g | B. | 6g | C. | 4.8g | D. | 2.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com