
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______,Na在氧气中完全燃烧所得产物的电子式为_______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BeO的熔点________(填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为______(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg3He同时可得6000kgH2和700kgN2,若以所得H2和N2为原料经一系列反应最多可制得碳酸氢铵___kg。
科目:高中化学 来源: 题型:
【化学——选修3:物质结构与性质】(15分)
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示。
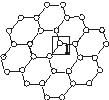
(a)石墨烯结构 (b)氧化石墨烯结构
(1)基态碳原子的核外电子有 种运动状态。
(2)图(a)中,1号C与相邻C形成σ键的个数为________。
(3)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。

(4)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
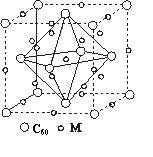
(5)石墨烯可转化为富勒烯分子(C60),C60属于________晶体,某
金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位
于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料
的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是 ( )
A.13C和14C属于同 一种元素,它们互为同位素
一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的核外电子数相等,中子数也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT.有关下列叙述中正确的是 ( )
A.三种物质质子数之比为1∶2∶3
B.三种物质中子数之比为1∶1∶1
C.三种物质的摩尔质量之比为8∶9∶10
D.三种物质的化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应2NO(g)+2CO(g)  2CO2(g)+N2(g) ΔH=-746.8 kJ/mol,可净化汽车尾气,如果要同时
2CO2(g)+N2(g) ΔH=-746.8 kJ/mol,可净化汽车尾气,如果要同时
提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),
xC(g)+2D(g),
经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min).求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol.
(2)B的平均反应速率v(B)=________mol/(L·min).
(3)x的值为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
[选做题]本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答。将按A题评分。
A.【物质结构与性质】
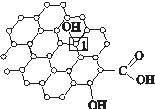
可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2  CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。 CaCN2中阴离子为CN ,根据等电子原理可以推知CN
,根据等电子原理可以推知CN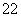 的空间构型为 。
的空间构型为 。
 (2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )
后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 。
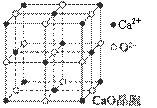

(5)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致CaO比NaCl晶格能大的主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com