
| A. | 2.4g金属镁全部变成镁离子时失去的电子数为0.1NA | |
| B. | 1.0 mol任何单质气体的分子数均为NA,原子数均为2NA | |
| C. | 17gNH3所含的电子数目为NA | |
| D. | 16g 02和03混合气体中.含有原子数为NA |
分析 A.镁为+2价金属,2.4g镁的物质的量为0.1mol,完全反应变成镁离子失去0.2mol电子;
B.稀有气体为单原子分子,臭氧为3原子分子;
C.氨气分子中含有10个电子,17g氨气的物质的量为1mol,含有10mol电子;
D.氧气和臭氧都只含有氧原子,16g二者的混合物中含有16g氧原子,含有氧原子的物质的量为1mol.
解答 解:A.2.4g金属镁的物质的量为:$\frac{2.4g}{24g/mol}$=0.1mol,0.1mol镁全部变成镁离子时失去0.2mol电子,失去的电子数为0.2NA,故A错误;
B.1.0 mol任何单质气体的分子数均为NA,但是含有的原子数均为不一定为2NA,如1mol臭氧含有3mol氧原子,1mol稀有气体含有1mol原子,故B错误;
C.17gNH3的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气中含有10mol电子,含有的电子数目为10NA,故C错误;
D.16g02和03混合气体中含有16个O,含有1mol氧原子,含有原子数为NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积为11.2L | B. | 物质的量为0.5mol | ||
| C. | 含有6.02×1023个分子 | D. | 与1g H2的体积一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水所含的原子数目为3NA | |
| B. | 一定条件下,等物质的量甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 标准状况下,17g氨气的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O的质量为16g•mol-1 | |
| B. | 1mol He约含有6.02×1023个原子 | |
| C. | 2H既表示2个氢原子,又表示2mol氢原子 | |
| D. | 1mol HCl约含有6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
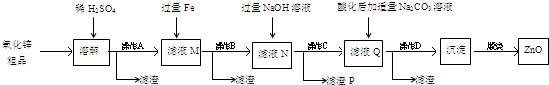
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com