
分析 钠与水发生反应2Na+2H2O=2NaOH+H2↑,n(NaOH)=n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol,n(AlCl3)=0.01L×6mol/L=0.06mol,发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,以此来解答.
解答 解:(1)n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol,由2Na+2H2O=2NaOH+H2↑可知,生成气体的体积为0.2mol×$\frac{1}{2}$×22.4L/mol=2.24L,
答:钠与水反应产生的气体的体积为2.24L;
(2)n(NaOH)=n(Na)═0.2mol,n(AlCl3)=0.01L×6mol/L=0.06mol,发生Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,则
Al3++3OH-=Al(OH)3↓、
0.06 0.18 0.06
Al(OH)3+OH-=AlO2-+2H2O
0.02 0.02
可知沉淀为0.06mol-0.02mol=0.04mol,
答:反应所得沉淀的物质的量为0.04mol.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意氢氧化铝的两性,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由Ⅱ可知X中一定存在SiO2 | B. | 无法判断混合物中是否含有Na2O | ||
| C. | 1.92 g固体成分为Cu | D. | 15.6 g混合物X中m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
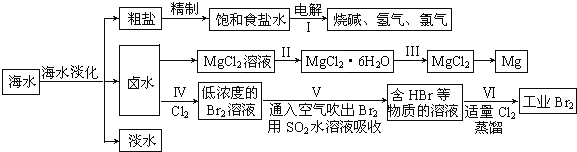
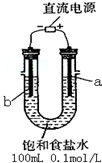
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA | |
| B. | 2.3 g钠在足量的氧气中燃烧,钠失去的电子数为0.2NA | |
| C. | 标准状况下,2g氢气所含原子数目为NA | |
| D. | 100mL0.2mol/L BaCl2溶液中Cl-的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液中不能确定是否存在CO32- | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol?L-1 | |
| D. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com