
 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:分析 (1)Cu为29号元素,原子核外有29个电子,结合能量最低原理书写核外电子排布式;Cu+的核外有28个电子,根据构造原理书写其基态离子核外电子排布式,原子轨道处于全空、半满或全满时最稳定;
(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别与H2O,CH4相似;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价;
(3)根据分子晶体的熔、沸点低;根据价层电子对互斥理论确定杂化类型;
(4)根据价层电子对互斥理论确定其杂化方式,提供空轨道的原子和提供孤电子对的原子之间形成配位键;
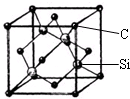
(5)根据原子晶体的硬度大;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,据此判断每个C原子周围最近的C原子数目;该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,根据ρ=$\frac{m}{V}$计算其密度.
解答 解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,CuO中铜的价层电子排布为3d94s0,Cu2O中铜的价层电子排布为3d10,3d10为稳定结构,所以在高温时,能生成Cu2O,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;CuO中铜的价层电子排布为3d 94s0,Cu2O中铜的价层电子排布为3d10,后者处于稳定的全充满状态而前者不是;(2)硒、硅均能与氢元素形成气态氢化物分别为H2Se,SiH4,其分子结构分别V形,正四面体;若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si,
故答案为:V形、正四面体;>;
(3)SeO2常温下白色晶体,熔、沸点低,为分子晶体;二氧化硒分子中价层电子对=2+$\frac{1}{2}$(6-2×2)=3,Se原子的杂化类型为sp2,且含有一个孤电子对,所以属于V形,
故答案为:分子晶体;sp2;
(4)BF3•NH3中B原子含有3个σ 键和1个配位键,所以其价层电子数是4,B原子采取sp3杂化,该化合物中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键,其结构简式可表示为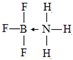 ,
,
故答案为:sp3;配位;
(5)金刚砂(SiC)的硬度为9.5,属于原子晶体;每个碳原子连接4个硅原子,每个硅原子又连接其它3个碳原子,所以每个碳原子周围最近的碳原子数目为3×4=12;该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=a×10-10cm,体积V=(a×10-10cm)3,ρ=$\frac{m}{V}$=$\frac{4×40}{(a×1{0}^{-10})^{3}×6.02×1{0}^{23}}$g•cm3,
故答案为:原子晶体;12;$\frac{4×40}{(a×1{0}^{-10})^{3}×6.02×1{0}^{23}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化判断、原子核外电子排布式的书写等知识点,难点是晶胞计算,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
反应其△H= -122 kJ·mol-1,∆S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.常温常压下,22.4L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06g Na2CO3含有的钠离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
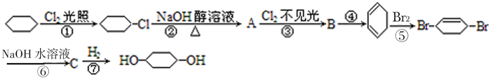
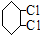 C:
C:
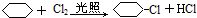 ;④:
;④: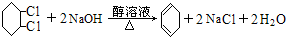 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
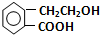 ,它可通过不同化学反应分别制得B、C、D三种物质.
,它可通过不同化学反应分别制得B、C、D三种物质.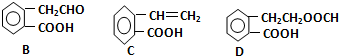
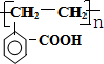 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
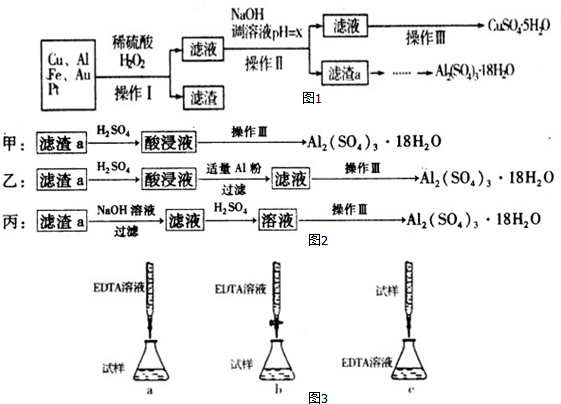
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com