
以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH变小
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1 2Hg(l)+O2(g)== =2HgO(s) ΔH=-181.6 kJ·mol-1则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为( )
=2HgO(s) ΔH=-181.6 kJ·mol-1则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH 0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率_ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在如图中,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如 果电解一段时间后,发现A极比C极重1.9 g,则
果电解一段时间后,发现A极比C极重1.9 g,则
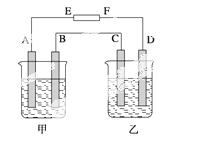
(1)电源E为________极,F为________极。
(2)A极的电极反应式为_____________________________________________,
析出物质______  mol。
mol。
(3)B极的电极反应式为________________________________________________,
析出气体________ mL(标准状况)。
(4)C极的电极反应式为_____________________________________________,
析出的物质________ mol。
(5)D极的电极反应式为_____________________________________________,
析出气体________ mL(标准状况)。
(6)甲烧杯中滴入石蕊试液,________极附近变红,如果继续电离,在甲烧杯中最终得到______溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
锂离子电池的总反应为LixC+Li1-xCoO2  C+LiCoO2
C+LiCoO2
锂硫电池的总反应2Li+S  Li2S
Li2S
有关上述两种电池说法正确的是( )
A.锂离子电池放电时, Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.下图表示用锂离子电池给锂硫电池充电

查看答案和解析>>
科目:高中化学 来源: 题型:
依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
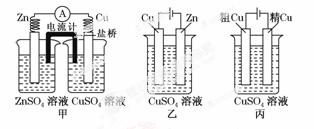
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.乙、丙装置中,c(Cu2+)基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应Fe(s)+CO2(g) 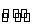 FeO(s)+CO(g)
FeO(s)+CO(g)
ΔH=akJ·mol-1,平衡常数为K。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为________。
(2)该反应为______(选填“吸热”或“放热”)反应。
(3)700℃时反应达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有___________(填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合该反应的是______(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
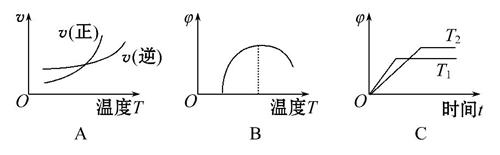
查看答案和解析>>
科目:高中化学 来源: 题型:
根据硝酸和硫酸所具有的性质,选择适当的字母按要求填空。
A.吸水性 B.脱水性 C.强氧化性 D.强氧化性和酸性
(1)浓硫酸常用作干燥剂,说明浓硫酸具有 ;
(2)用玻璃棒蘸浓硫酸滴在纸上,发现变黑,说明浓硫酸具有 ;
(3)浓硫酸和浓硝酸都可以与铜反应,反应中浓硫酸和浓硝酸显示出 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com