
| A、0.1molCl2参加反应,转移的电子数一定为0.2NA |
| B、0.1molO2参加反应,转移的电子数一定为0.4NA |
| C、0.1molAl参加反应,转移的电子数一定为0.3NA |
| D、0.1molFe参加反应,转移的电子数一定为0.2NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| t/min | CO(g)/(mol?L-1) | H2O(g)/(mol?L-1) | CO2(g)/(mol?L-1) | H2(g)/(mol?L-1) |
| 0 | 0.20 | 0.3 | 0 | 0 |
| 3 | 0.08 | 0.18 | c | c |

查看答案和解析>>
科目:高中化学 来源: 题型:
 图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:
图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 化合物 |
A | B | C | D |
| Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
| W | MgO | Al2O3 | CO | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NH4Cl+NaOH
| ||||
B、3CO+Fe2O3
| ||||
| C、Cl2+2KBr═Br2+2KCl | ||||
| D、NH3+CO2+H2O═NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 四种基本反应类型与氧化还原反应的关系 |
B、 AlCl3溶液滴加NaOH溶液生成沉淀的情况 |
C、 Ba(OH)2溶液中滴加硫酸溶液导电性的情况 |
D、 等体积等浓度稀硫酸分别与足量铁和镁反应的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4+H2S=CuS↓+H2SO4 | ||||
B、Cu2(OH)2CO3
| ||||
| C、2FeCl3+Cu=2FeCl2+CuCl2 | ||||
| D、4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2+H2O
| ||||
B、Cu(OH)2
| ||||
C、Fe2O3+3CO
| ||||
| D、NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
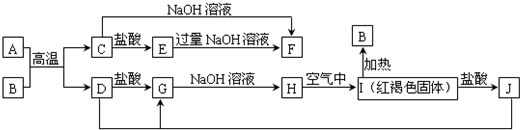
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com