
某溶液中可能存在Br﹣、CO32﹣、SO32﹣、Al3+、I﹣、Mg2+、Na+等7种离子中的几种.现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中肯定不存在的离子组是( )
|
| A. | Al3+、Mg2+、I﹣、SO32﹣ | B. | Mg2+、Na+、CO32﹣、I﹣ |
|
| C. | Al3+、Na+、SO32﹣、I﹣ | D. | Al3+、CO32﹣、Br﹣、SO32﹣ |
| 常见离子的检验方法;离子共存问题.. | |
| 专题: | 离子反应专题. |
| 分析: | ①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br﹣,且有无色气泡冒出,说明溶液中含离子CO32﹣; ②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32﹣; ③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,说明溶液中不含I﹣.以此解答该题. |
| 解答: | 解:①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br﹣,且有无色气泡冒出,说明溶液中含离子CO32﹣; ②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32﹣; ③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,说明溶液中不含I﹣. 溶液中含有CO32﹣,则一定不含有Al3+、Mg2+,因与CO32﹣反应生成沉淀, 根据溶液呈电中性原则,溶液中一定含有Na+, 所以溶液中一定不存在的离子为Al3+、Mg2+、I﹣、SO32﹣,一定含有的离子为CO32﹣、Br﹣、Na+, 故选A. |
| 点评: | 本题考查离子的检验及离子共存问题,题目难度中等,注意把握反应的实验现象,结合离子的性质进行判断. |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3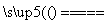 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知Fe(OH)3胶粒带正电荷。Al(OH)3胶粒也带正电荷,而H2SiO3胶粒带负电荷,则下列实验的现象分别是:
①Fe(OH)3胶体和Al(OH)3胶体混合: _______________________________________。
②Fe(OH)3胶体和H2SiO3胶体混合: ______________________________________。
(2)已知Al(OH)3胶体能够净水,则Fe(OH)3胶体________(填“能”或“不能”)净水。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S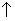
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
现取该溶液进行有关实验,实验过程及现象如下:
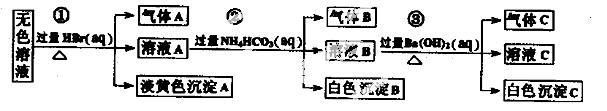
下列说法正确的是
A.根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr
B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+
C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | NaHSO4、Na2O2晶体中的阴、阳离子个数比均为1:2 |
|
| B. | 离子化合物中一定不含共价键 |
|
| C. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m﹣nR |
|
| D. | 元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有关海洋中部分资源的利用(如图)的说法不正确的是( )
|
| A. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 |
|
| B. | 用MgCl2•6H2O晶体制无水MgCl2,需在HCl气流中加热脱水 |
|
| C. | SO2水溶液吸收Br2的化学方程式为Br2+SO2+2H2O═H2SO4+2HBr |
|
| D. | 粗碘中混有少量ICl和IBr,可加入KI进行升华提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4﹣+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
|
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4﹣在反应中失去5mol电子 |
|
| C. | 该反应右框内的产物是OH﹣ | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32—、SO32—、SO42—、C1—、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
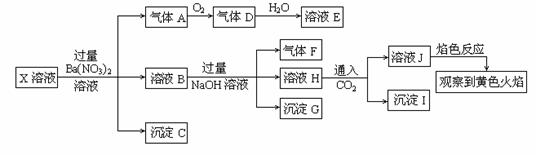
下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42—
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+ 、Na+、K+和C1—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com