
已知BaSO4和CaSO4的溶度积分别为1.1×10-10 mol2·L-2和9.1×10-6 mol2·L-2.计算:
(1)将0.5 L 2.0×10-3 mol·L-1的BaCl2溶液与0.5 L 2.0×10-3 mol·L-1的Na2SO4溶液混合,________(填“有”或“没有”)沉淀生成,原因是________.如果有沉淀生成,则生成的沉淀的物质的量是________mol.
(2)现有0.010 mol CaSO4,要把它配成CaSO4饱和溶液,最多加多少体积水?
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 2NH3(g)△H=-92kJ?mol-1
2NH3(g)△H=-92kJ?mol-1 2NH3(g)△H=-92kJ?mol-1
2NH3(g)△H=-92kJ?mol-1 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) H++HCO3-
H++HCO3- H++HCO3-
H++HCO3- H++NH3?H2O
H++NH3?H2O H++NH3?H2O
H++NH3?H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:实验题
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:

(1)氧化过程主要反应的离子方程式为 。
(2)沉淀C的主要成分是Ca(OH)2和 。
由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。

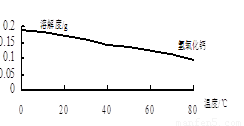
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1 的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后, ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为 。
③步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
查看答案和解析>>
科目:高中化学 来源:2010年四川省高一上学期期中考试化学试卷 题型:选择题
已知NaHCO3溶液和NaOH溶液反应的离子方程式为:HCO3-+OH-=CO32-+H2O,NaHCO3在水中的电离方程式为:NaHCO3= Na++HCO3-,下列离子方程式不正确的是
A.Ba(HCO3)2溶液和硫酸混合:Ba2++ SO42-+2H+ +2HCO3-=BaSO4↓+ 2H2O+2CO2↑
B.Ba(HCO3)2溶液和Ba(OH)2溶液混合:Ba2++OH-+HCO3-=BaCO3↓+ H2O
C.等体积、等浓度Ca(HCO3)2溶液和NaOH溶液混合:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.等体积、等浓度Ba(OH)2溶液和NaHCO3溶液混合:Ba2++OH-+HCO3-=BaCO3↓+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com