

| △n |
| V?t |
| △n |
| V?t |
| 0.5mol |
| 2L×5min |
| (3×10-3)2 |
| 0.25×0.04 |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| 乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
| A、萃取法 | B、过滤法 |
| C、分液法 | D、蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
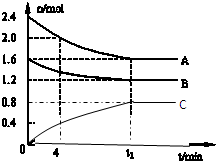 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.| n(A) |
| n(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7;Ka2=5.6×10-11 |
| A、物质的量浓度相等的三种溶液中,pH大小关系为:pH( NaCN)>pH(Na2 CO3 )pH(CH3COONa) |
| B、amol?L-1 HCN与6 mol?L-1NaOH溶液等体积混合所得的溶液中c(Na+)>c(CN-),则a一定小于b |
| C、向冰醋酸中逐滴加水稀释的过程中,溶液导电能力先增大,后减小 |
| D、将0.1 mol?L-1的Na2 CO3溶液逐滴加入到等浓度的HCN溶液中,无明显现象,说明未反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强不变 |
| D、BaO2量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:2 |
| B、2:2:1 |
| C、2:3:1 |
| D、4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-溴丁烷 |
| B、3,3-二甲基-2-氯戊烷 |
| C、2,2-二甲基-1-氯丁烷 |
| D、1,3-二氯苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )
一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )| A、降低温度可以加快正反应速率 |
| B、反应体系中加入催化剂可增加反应热 |
| C、降低温度可以提高NH3的转化率 |
| D、增加空气的量可以提高混合气体中NO的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com