
按照下列实验方法可以达到目的的是 ( )
A.将铜丝用盐酸洗涤后,蘸NaC1溶液,在酒精灯上灼烧观察焰色为黄色证明含有Na+
B.淀粉与浓硫酸充分反应后,加入适量的新制的Cu(OH)2,加热煮沸后有砖红色沉淀
C.为提高高锰酸钾的氧化能力可以用浓盐酸酸化
D.用焰色反应可以鉴别NaC1、KC1、CuC12
科目:高中化学 来源: 题型:阅读理解

 或
或 表示密闭容器;
表示密闭容器;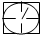 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.| 3.2 |
| at |
| 3.2 |
| at |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 表示密闭容器;
表示密闭容器;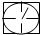 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



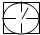
查看答案和解析>>
科目:高中化学 来源:2007-2008学年云南省曲靖市宣威八中高三(上)化学实验综合检测试卷(解析版) 题型:填空题

 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com