
常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液 NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时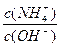 的值将 (填“变小”,“变大”或“不变”);
的值将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点,理由是;
;
②a点溶液中离子浓度大小关系是 ;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.
| ||
| ||
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com