
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
 ;
; .
.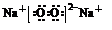 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号). 分析 由元素在周期表中的位置可知,①为N,②为K,③为Mg,④为F,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为Br,⑩为Ar.
(1)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;MgF2中镁离子和氟离子之间只存在离子键,为离子化合物;
(2)①的气态氢化物为NH3,最高价氧化物水化物为HNO3,二者反应生成NH4NO3;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(3)金属性越强,最高价氧化物对应的水化物碱性越强;氢氧化钾与氢氧化铝能反应生成偏铝酸钾和水;
(4)氯气与溴化钾反应生成氯化钾与溴单质;溴易溶于CCl4且CCl4密度比水大;
(5)与②同主族,第三周期元素为Na,钠在氧气中燃烧生成过氧化钠,过氧化钠是离子化合物;非金属性越强,阴离子还原性越弱.
解答 解:由元素在周期表中的位置可知,①为N,②为K,③为Mg,④为F,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为Br,⑩为Ar.
(1)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ;氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为
;氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 ,
,
故答案为: ;
; ;
;
(2)①的气态氢化物为NH3,最高价氧化物水化物为HNO3,二者反应生成NH4NO3,离子方程式为:NH3+H+=NH4+;
电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,第三周期中除⑩元素以外离子半径最小的是Al3+,
故答案为:NH3+H+=NH4+;Al3+;
(3)同周期自左而右金属性减弱,同主族自上而下金属性增强,故金属性K>Mg>Al,金属性越强,最高价氧化物对应的水化物碱性越强,故KOH的碱性最强;氢氧化钾与氢氧化铝能反应生成偏铝酸钾和水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:KOH;有;Al(OH)3+OH-=AlO2-+2H2O;
(4)氯气与溴化钾反应生成氯化钾与溴单质,反应离子方程式为:Cl2+2Br-=2Cl-+Br2,在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为:溶液分层,下层为橙红色,上层为无色,
故答案为:Cl2+2Br-=2Cl-+Br2;溶液分层,下层为橙红色,上层为无色;
(5)与②同主族,第三周期元素为Na,钠在氧气中燃烧生成过氧化钠,过氧化钠由钠离子与过氧根离子通过离子键形成,电子式为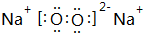 ;非金属性越强,阴离子还原性越弱,故阴离子还原性:Br->Cl->F-,
;非金属性越强,阴离子还原性越弱,故阴离子还原性:Br->Cl->F-,
故答案为: ;Br->Cl->F.
;Br->Cl->F.
点评 本题考查周期表和周期律的应用,为高频考点,侧重于分析与应用能力的考查,把握元素的位置和性质、元素周期律等为解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g18O2含有的中子数为10NA | B. | 1.9g1H37Cl含有的电子数为0.9NA | ||
| C. | lmolN2中共用电子对数为3NA | D. | 0.5molNH4+含有的质子数为5.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若食用油在锅内因过热着火,应立即盖上锅盖 | |
| B. | 为了安全,食品中不允许加入任何添加剂 | |
| C. | 新装修房屋释放甲醛,要通风一段时间后再入住 | |
| D. | 次氯酸盐和洁厕剂(含盐酸)不能混合使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com