
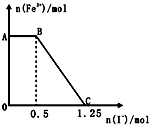
 ��֪���Ը��������Һ���Խ�FeSO4��������ѧ��Ӧ�ķ���ʽΪ��2KMnO4+10FeSO4+8H2SO4�TK2SO4+2MnSO4+5Fe2��SO4��3+8H2O���ֽ�һ�����������ữ�ĸ��������Һ������������Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ�������ӵ����ʵ���������KI�� ���ʵ����ı仯��ϵ��ͼ��ʾ���������й�˵������ȷ���ǣ�������
��֪���Ը��������Һ���Խ�FeSO4��������ѧ��Ӧ�ķ���ʽΪ��2KMnO4+10FeSO4+8H2SO4�TK2SO4+2MnSO4+5Fe2��SO4��3+8H2O���ֽ�һ�����������ữ�ĸ��������Һ������������Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ�������ӵ����ʵ���������KI�� ���ʵ����ı仯��ϵ��ͼ��ʾ���������й�˵������ȷ���ǣ�������| A�� | ͼ��AB����Ҫ�Ǹ�����غ͵⻯����Һ��Ӧ | |
| B�� | ͼ��BC�η����ķ�ӦΪ2Fe3++2I-�T2Fe2++I2 | |
| C�� | ����OC�ε����ݿ�֪��ʼ����ĸ�����ص����ʵ���Ϊ0.25mol | |
| D�� | ��C���Ժ����Һ�м�������KSCN��Һ����Һ���ɫ |
���� ���ݷ�Ӧ����ʽ��֪������ǿ��˳��Ϊ��KMnO4��Fe3+����ͼ���֪���ڷ�Ӧ�����Һ�еμӵ⻯����Һ����ʼʱFe3+Ũ�Ȳ��䣬��˵��Fe3+û�вμӷ�Ӧ����ABӦΪ������غ͵⻯�صķ�Ӧ��BC��Ϊ�����Ӻ͵⻯�صķ�Ӧ����ϵ�ʧ�����غ�����⣮
��� �⣺A����ʼʱFe3+Ũ�Ȳ��䣬��˵��Fe3+û�вμӷ�Ӧ����ABӦΪ������غ͵⻯�صķ�Ӧ����A��ȷ��
B��BC��Fe3+Ũ����С��Ϊ�����Ӻ͵⻯�صķ�Ӧ����Ӧ�����ӷ���ʽΪ��2Fe3++2I-=2Fe2++I2����B��ȷ��
C�����������ͻ�ԭ����ʧ������Ŀ��ȿ�֪��Ӧ�Ĺ�ϵʽΪ��2KMnO4��10Fe3+��10I-�������ĵ�n��I-��=1.25mol����ʼ����ĸ�����ص����ʵ���Ϊ��$\frac{1.25}{5}$mol=0.25mol����C��ȷ��
D��C��ʱ��Fe3+Ũ��Ϊ�㣬Fe3+��Һ��û�У�������C���Ժ����Һ�м�������KSCN��Һ����Һ����ɫ����D����
��ѡC��
���� ���⿼�����ﷴӦ�ļ��㣬������ѧ���ķ��������ͼ��������Ŀ��飬Ϊ�߿��������ͺ�Ƶ���㣬��Ŀ�Ѷ��еȣ�ע�����շ�Ӧ����ط���ʽ����д�����ݷ���ʽ����ϵʽ������⣮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ӷ�Ӧ����� | B�� | ����ѹǿ | C�� | ���� | D�� | ��Сѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
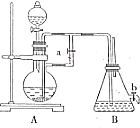 ��ͼ��ʾװ�ã���������ȡ�۲�Fe��OH��2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6mol/L�����ᣬ�����Լ���ѡ��
��ͼ��ʾװ�ã���������ȡ�۲�Fe��OH��2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6mol/L�����ᣬ�����Լ���ѡ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3+HCl�TNH4Cl | B�� | 4NH3+5O2 $\frac{\underline{\;\;��\;\;}}{\;}$ 4NO+6H2O | ||
| C�� | 3CuO+2NH3 $\frac{\underline{\;\;��\;\;}}{\;}$ 3Cu+N2+3H2O | D�� | 8NH3+3Cl2 $\frac{\underline{\;\;��\;\;}}{\;}$ 6NH4Cl+N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪2H2��g��+O2��g���T2H2O��l������H=-483.6kJ/mol����������ȼ����Ϊ241.8kJ/mol | |
| B�� | C��s��ʯī��=C��s�����ʯ������H=+1.9kJ•mol-1��˵�����ʯ��ʯī�ȶ� | |
| C�� | CaCO3��s���TCaO��s��+CO2��g����H��0����S��0���÷�Ӧ�κ��¶��¶����Է����� | |
| D�� | ��֪��C��s��+$\frac{1}{2}$O2��g���TCO��g����H1��C��s��+O2��g���TCO2��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4 L H2O ������Ϊ18 g | |
| B�� | 0.5 mol O2�к��еķ�����ԼΪ6.02��1023 | |
| C�� | 0.1 mol/L Na2CO3��Һ�к�Na+�����ʵ���Ϊ0.1 mol | |
| D�� | ���³�ѹ�£�1.7 g NH3���е�������ԼΪ6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com