
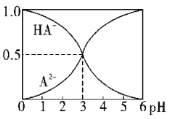
【题目】室温下,0.1mol·L-1的某二元酸H2A溶液中,逐渐加入NaOH溶液,可能存在的含A粒子的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
A.H2A的电离方程式:H2A![]() H++HA-
H++HA-
B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-)
D.Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0
【答案】BC
【解析】
A. 二元酸H2A溶液中不存在其分子,说明第一步完全电离,二元酸H2A的电离方程式为:H2A=H++HA-,HA-H++A2-,A项错误;
B.由图中pH=3时数据,可求得HA-的电离平衡常数Ka=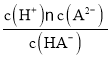 =1×10-3,温度不变,电离常数不变,pH=5时电离常数Ka=
=1×10-3,温度不变,电离常数不变,pH=5时电离常数Ka=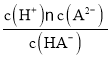 =
=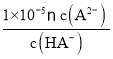 =1×10-3,解得c(HA-):c(A2-)=1:100,B项正确;
=1×10-3,解得c(HA-):c(A2-)=1:100,B项正确;
C. 由HA-只存在与pH<6的溶液中,可知在等物质的量浓度的NaHA和Na2A的混合溶液中,HA-的电离程度大于A2-的水解程度,故离子浓度大小关系应为c(Na+)>c(A2-)>c(HA-), C项正确;
D. 二元酸H2A的电离方程式为:H2A=H++HA-,HA-H++A2-,Na2A溶液中不存在H2A分子,c(H2A) =0,D项错误;
答案选BC。


科目:高中化学 来源: 题型:
【题目】下列叙述与下图对应的是( )
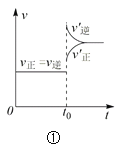
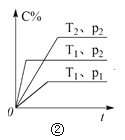
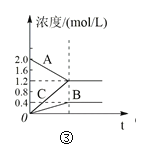
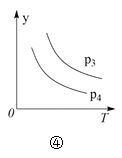
A.对于达到平衡状态的N2(g) + 3H2(g) 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动
B.由图②可知,p2 > p1,T1 > T2满足反应:2A(g) + B(g) 2C(g) ΔH < 0
C.图③表示的反应方程式为2A = B + 3C
D.对于反应2X(g) + 3Y(g) 2Z(g) ΔH < 0,图④y轴可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的下列说法正确的是
A.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
B.等质量的乙烯和甲烷燃烧时,乙烯消耗氧气多
C.苯分子中的碳碳键为单键与双键交替存在
D.乙烯和乙烷可用溴水来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应平衡常数K= ![]() 。恒容条件下达到平衡时,温度升高H2浓度减小。下列说法正确的是( )
。恒容条件下达到平衡时,温度升高H2浓度减小。下列说法正确的是( )
A.该反应的化学方程式为CO+H2O ![]() CO2+H2B.该反应的焓变为正值
CO2+H2B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小 D.升高温度,平衡右移,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
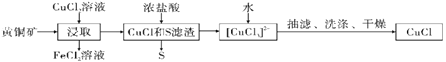
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
[CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
A.浸取阶段,参加反应的CuFeS2和CuCl2的物质的量之比为3:l
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuCl
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用生物电化学方法脱除水体中NH4+的原理如图所示。
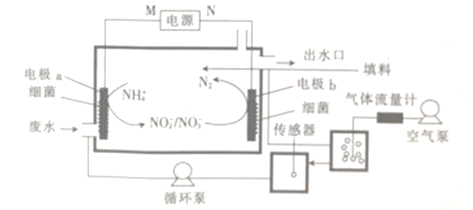
下列说法正确的是
A. M为电源的负极,N为电源的正极
B. 装置工作时,电极a周围溶液的pH降低
C. 装置内工作温度越高,NH4+的脱除率一定越大
D. 电极b上发生的反应之一为2NO2-+8H++8e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种反应类型:①消去 ②取代 ③水解 ④加成 ⑤还原 ⑥氧化,用丙醛制取1,2-丙二醇 ( ),按正确的合成路线依次发生的反应所属类型不可能是( )
),按正确的合成路线依次发生的反应所属类型不可能是( )
A. ⑤⑥③① B. ⑤①④③ C. ⑤①④② D. ④①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的催化裂解可按下列两种方式进行:C4H10→C2H6+C2H4; C4H10→CH4+C3H6;某化学兴趣小组的同学为探究丁烷裂解气中CH4和C2H6的比例关系,设计如图所示实验:
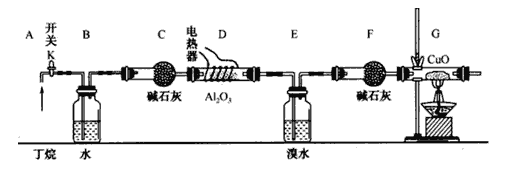
注:CuO能将烃氧化成CO2和H2O;A12O3是丁烷裂解的催化剂,G后面装置已省略。如图连接好装置后(部分夹持装置已略去),需进行的实验操作有:
①给D、G装置加热:②检査整套装置的气密性;③排尽装置中的空气。
(1)这三步操作的先后顺序依次是____________。
(2)简要说明检验空气排尽的方法:_______________________________________________。
(3)B装置所起的作用是__________________________________________。
(4)假设丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了 1.82g, G装置中固体质量减少了 4.l6g,则丁烷的裂解产物中n(CH4)∶n(C2H6)=_____________。
(5)若对E装置中的混合物再按以下流程实验:

①分离操作I、Ⅱ的名称是I_____________、 II_______________;
②Na2SO3溶液的作用是(用离子方程式表示)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常量的值,最早由奥地利化学及物理学家JohannJosefLoschmidt测得,有时候用L代替NA表示阿伏伽德罗常量的值,下来说法错误的是
A.1.1g的11B中,含有0.6L个中子
B.pH=1的H3PO4溶液中,含有0.1L个H+
C.标准状态下的33.6L氯气与27g铝充分反应,转移电子数为3L
D.1L1mol/LNaCl溶液和1L1mol/LNaF溶液中离子总数:前者大于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com