
【题目】下列各组混合物中,能用分液漏斗进行分离的是
A. 水和四氯化碳 B. 碘和四氯化碳 C. 酒精和水 D. 汽油和植物油
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表标出的是元素周期表的一部分元素,回答下列问题:
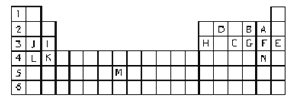
①表中用字母标出的14种元素中,化学性质最不活泼的是____________(用元素符号表示,下同),金属性最强的是____________,常温下单质为液态的非金属元素是____________。
②B、F、C气态氢化物中以________(填分子式)最不稳定。
Ⅱ. 有短周期的A、B、C、D、E 五种元素,它们在周期表的位置如图所示。已知A原子最外层电子数是次外层电子数的2倍。试回答下列问题:
![]()
(1) 元素E在周期表中位于第_______周期_______族。
(2) 元素A的最高价氧化物的电子式为________,元素D的原子结构示意图为________;
(3) 比较C、D两种元素最高价氧化物对应水化物的酸性强弱:______ > ______。(用分子式表示)
(4)元素C的气态氢化物与元素E的最高价氧化物对应水化物化合生成的正盐的化学式为___________,该盐的晶体类型为________。
(5) ①元素B所在周期的简单离子半径最小的是______。(用离子符号表示)
②元素C、D的简单氢化物沸点较高的是______。(用分子式表示)
(6)请用电子式表示Na2S的形成过程____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是 ( )
A.加入Al生成H2的溶液:CO32-、NH4+、Cl-、K+
B.酸性溶液中:K+、Na+、SiO32-、Cl-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.硫酸钠的溶液中:Mg2+、NO3-、K+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予研究“分子机器的设计与合成”的三位科学家。轮烷是一种分子机器的轮子,合成轮烷的基本原料有苯、丙烯、二氯甲烷、戊醇。下列说法正确的是( )
A. 苯能与溴水发生加成反应 B. 丙烯能被酸性KMnO4氧化
C. 戊醇易溶于水 D. 二氯甲烷有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含1 mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是
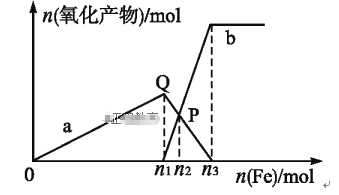
A. 曲线a表示Fe2+,曲线b表示Fe3+
B. P点时总反应的离子方程式可表示为5Fe+16H++NO3-![]() 3Fe2++2Fe3++4NO↑+8H2O
3Fe2++2Fe3++4NO↑+8H2O
C. n2=0.25
D. n3∶n1=3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是____和____(填化学式,且相对分子质量小的写在第一个空)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时,产生棕黄色沉淀(红白混合颜色),向该沉淀中滴入稀硝酸,沉淀部分溶解,最后留有白色沉淀不再溶解。则X为____。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液不显中性,原因主要为______________________________(用离子方程式表示)。
(4)将0.02 mol A与0.01 mol C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为_____。
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀硫酸,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的____________(填相应的离子符号)。有关反应的离子方程式为_______________________________________________。
(6)利用上述已经确定的物质,可能检验出D、E中的阳离子。请简述实验操作步骤、现象及结论:__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见化合物.它们在一定条件下可以发生如图反应(均不是在溶液中进行的反应)(以下每个空中只需填入一种物质)
(1)X、Y均为金属时,此反应在工业上称为___反应,其反应方程式为________
(2)X为金属,Y为非金属时,A为__B__
(3)X为非金属Y为金属时,A为__B为_______
(4)X为非金属,Y为非金属时,A为_____B为______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)____I-+____IO3—+____H+ =____I2+____H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:____________________________。
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是_______,上述操作正确的顺序是:_______(填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________。
②b中反应所消耗的KI的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)_____mg/kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___________(用元素符号填空)。
(2)DA2分子的VSEPR模型是___________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______晶体(填晶体类型),其中C原子的杂化轨道类型为____杂化。
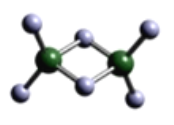
②[C(OH)4]-中存在的化学键有________。
(4)B、C的氟化物晶格能分别是2957 kJ·mol-1 、5492 kJ·mol-1 ,二者相差很大的原因是____________。
(5)D与E形成化合物晶体的晶胞如下图所示:
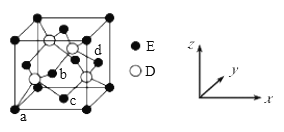
①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2);c为(1/2,1/2,0)。则d原子的坐标参数为_______。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com