
分析 (1)根据化合价的变化判断氧化还原反应的相关概念,根据氧化还原反应中氧化剂和还原剂之间得失电子的物质的量相等计算转移电子的物质的量,在氧化还原反应中还原剂的还原性大于还原产物的还原性;
(2)根据化合价的变化计算转移电子的物质的量;
(3)根据氧化还原反应中氧化剂和还原剂之间得失电子的物质的量相等计算;
(4)反应10FeS+6KMnO4+24H2SO4→3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O中,反应前后固体变化为:FeS→S,固体减少的质量实际上是铁元素的质量,据此计算出铁的物质的量及转移的电子数.
解答 解:(1)a.反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,化合价升高的元素被氧化,所以被氧化的元素有S、Cu,故a正确;
b.锰元素化合价降低,从+7价降低为+2价,Cu2S元素化合价都升高做还原剂,1molMnO4-得到5mol电子,反应中铜元素化合价从+1价升高到+2价,硫元素化合价从-2价升高到+4价,1molCu2S失去8mol电子,则氧化剂与还原剂的物质的量之比为8:5,故b正确;
c.生成2.24LL(标况下)SO2时,物质的量为0.1mol;反应的Cu2S物质的量为0.1mol,反应中转移电子的物质的量是:
Cu+~Cu2+~e-; S2-~SO2~6e-;
1 1 1 6
0.2mol 0.2mol 0.1mol 0.6mol
所以电子转移共0.8mol,故c正确;
d.氧化还原反应中还原剂的还原性大于还原产物的还原性,则还原性的强弱关系是:Mn2+<Cu2S,故d错误.
故选d.
(2)由H2O2-2e→2H++O2↑可知,反应中若有0.5mol H2O2参加此反应,转移电子的个数为0.5×2×NA=NA,故答案为:NA;
(3)反应2KMnO4+7H2O2+3H2SO4→K2SO4+2MnSO4+6O2↑+10H2O中,2molKMnO4可氧化5molH2O2,生成的6molO2中,有5mol为H2O2被氧化生成,有1mol为H2O2自身发生氧化还原反应生成,则1mol KMnO4氧化的H2O2是2.5mol,故答案为:2.5;
(4)反应中固体质量变化为:FeS→S,固体质量变化为铁元素的变化;反应前后固体的质量减少了2.8g,参加反应的亚铁离子的物质的量为:$\frac{8g}{56g/mol}$=0.05mol,即被氧化的FeS的物质的量为0.05mol,被高锰酸根离子氧化的硫元素元素的物质的量为0.05mol,转移的电子的物质的量为:0.05mol×2=0.1mol,电子数目为:0.1NA,
故答案为:0.1NA.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识相关概念并进行计算,难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氟的原子半径比氯的原子半径小 | B. | 氟化氢比氯化氢稳定 | ||
| C. | 氟的最高价是+7价 | D. | 氟气的氧化性比氯气的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示氢溴酸的形成过程为: | |
| B. | 乙烯的结构简式:C2H4 | |
| C. | 四氯化碳的电子式为: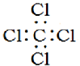 | |
| D. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | W元素的晶体单质是一种良好的半导体材料 | |
| C. | X分别与Y,Z,M,W形成的常见化合物中,稳定性最好的是XM | |
| D. | 化合物乙中一定只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 正、逆反应速率都为零 | D. | 反应体系中混合物的组成保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液(BaCl2) | B. | FeCl2溶液(KSCN) | ||
| C. | 海带灰过滤所得的溶液(淀粉溶液) | D. | NaOH溶液(CaCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A酸比B酸的电离程度小 | |
| B. | A是强酸,B是弱酸 | |
| C. | pH=1时,B酸的物质的量浓度比A酸大 | |
| D. | 将pH=1的A酸和B酸稀释成pH=5的溶液,A酸所需加入的水量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 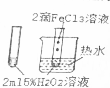 验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 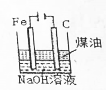 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  验证盐酸、碳酸、苯酚酸性的强弱 | |
| D. |  制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2和CH2═CH2的最简式相同 | |
| B. | 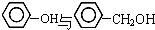 相差一个CH2,互为同系物 相差一个CH2,互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的乙炔、苯、苯乙烯(C8H8)分别完全燃烧,耗氧量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com