
【题目】铱(Ir)和锇(Os)属于铂族金属,与金、银合称贵重金属,可以用于电气、精密仪表、催化剂等领域。铱锇矿的主要成分有Ir、Os、Ir2O3、OsO2,还含有CuO和SiO2等杂质,从铱锇矿中提取铱(Ir)和锇(Os)的流程如下:
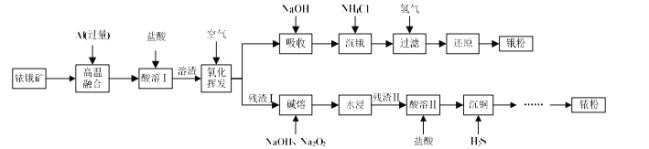
已知:①高温融合发生反应的原理类似于铝热反应。
②四氧化锇(OsO4)的熔点为41℃,易挥发、有恶臭和剧毒。
③四氨合二氧氯化锇([OsO2(NH3)4]Cl2)呈浅黄色,难溶于有机物,微溶于水,能水解。
回答下列问题:
(1)“酸溶I”的目的是_____________________________________;酸溶I后溶渣的主要成分除Ir、Os外,还有_______ (填化学式)。
(2)“氧化挥发”是将溶渣置于300~800 ℃的管式炉内,通入空气氧化。用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为 __________________;当吸收液质量增加59.5 g时,反应转移电子的数目为 ______。
(3)“沉锇”时, NH4Cl与Na2OsO4发生反应Na2OsO4 + 4NH4Cl=[OsO2(NH3)4]Cl2↓ + 2NaCl + 2H2O,该过程中NH4Cl需过量,目的是_____________________________ ;生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的原因是____。
(4)“残渣I”的主要成分为Ir、CuO和SiO2。“碱熔”时,Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为 _______________________。
(5) “沉铜” 过程中,当通入H2S 达到饱和时测得溶液的pH=1,此时溶液中c(Cu2+)为____。[已知:25 ℃下,H2S溶于水形成饱和溶液时,c(H2S)=0.1mol/L;H2S的电离常数![]() ,
,![]() ;
;![]() ]
]
【答案】溶解Al、溶解Al2O3与贵重金属分离 Cu、SiO2 2OsO4 + 4OH-=2OsO42-+ O2↑+ 2H2O 0.5NA 使锇元素完全转化为[OsO2(NH3)4]Cl2沉淀,提高回收率 减少[OsO2(NH3)4]Cl2的损耗,无水乙醇易挥发使固体迅速干燥,防止水解 2Ir+ 2nNa2O2![]() 2IrO2·nNa2O + (n-2)O2↑ 6×10-17 mol/L
2IrO2·nNa2O + (n-2)O2↑ 6×10-17 mol/L
【解析】
铱锇矿和过量Al高温融合,发生铝热反应后固体混合物的成分为Ir、Os、Cu、Al、Al2O3和SiO2;用盐酸完全溶解Al和氧化铝后过滤,所得溶渣为Ir、Os、Cu和SiO2,将溶渣在空气中高温氧化挥发,用NaOH溶液吸收OsO4得Na2OsO4溶液,向Na2OsO4溶液中加入过量NH4Cl达到沉锇目的,经过滤得[OsO2(NH3)4]Cl2,再经还原即可得到锇粉;同时氧化挥发后的残渣Ⅰ的主要成分为Ir、CuO和SiO2,用NaOH和Na2O2进行碱溶,其中Ir与Na2O2反应生成IrO2·nNa2O和O2,经水洗过滤后,浅渣Ⅱ为IrO2·nNa2O和CuO,用盐酸溶解IrO2·nNa2O和CuO后,向溶液中通入过量H2S气体,利用生成CuS达到沉铜的目的,最后经过滤后,滤液经系列操作可得铱粉,据此分析解题。
(1)“酸溶I”是用盐酸溶解固体混合物中的Al和Al2O3,达到与贵重金属铱和锇分离的目的;Ir、Os、Cu和SiO2均不溶于稀盐酸,则酸溶I后溶渣的主要成分除Ir、Os外,还有Cu、SiO2;
(2)用NaOH溶液吸收OsO4生成Na2OsO4,Os元素发生了还原反应,则反应中同时有O2生成,结合守恒法,可知发生反应的离子方程式为2OsO4 + 4OH-=2OsO42-+ O2↑+ 2H2O;由反应可知,每溶解2molOsO4生成1molO2,转移4mol电子,同时溶液增重质量为254g/mol×2mol-32g=476g,则当吸收液质量增加59.5g时,反应转移电子的数目为![]() ×4mol×NAmol-1=0.5NA;
×4mol×NAmol-1=0.5NA;
(3)“沉锇”时, 添加过量NH4Cl,促进反应完全进行,使锇元素完全转化为[OsO2(NH3)4]Cl2沉淀,提高回收率;[OsO2(NH3)4]Cl2)难溶于有机物,微溶于水,能水解,则洗涤时应选择无水乙醇,可减少[OsO2(NH3)4]Cl2的损耗,无水乙醇易挥发使固体迅速干燥,防止水解;
(4)碱熔时,Ir与Na2O2反应生成IrO2·nNa2O和O2,结合守恒法,发生反应的化学方程式为2Ir+ 2nNa2O2![]() 2IrO2·nNa2O + (n-2)O2↑;
2IrO2·nNa2O + (n-2)O2↑;
(5)已知H2SHS-+H+,HS-H++S2-,则Ka1×Ka2= ,H2S饱和时c(s2-)=
,H2S饱和时c(s2-)=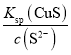 =
=![]() mol/L=6×10-17 mol/L。
mol/L=6×10-17 mol/L。


科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.48g 正丁烷和 10g 异丁烷的混合物中共价键数目为 13NA
B.标准状况下,22.4LCl2 与水充分反应,转移电子数为 NA
C.标准状况下,1L 液态水中含有的H+数为 10ˉ7NA
D.2.0g D2O 和 H218O 的混合物中含有的质子数和中子数之和为 1.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol NH4+中含有的电子数为11 NA
B.0.1mol·L-1的Ba(OH)2溶液中含有的OH- 数目为0.2NA
C.0.1NA个氯分子溶于1L水中,所得溶液中c(C1-)=0.1mol·L-1
D.1mol NH3溶于水中配成1L溶液,所得氨水的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
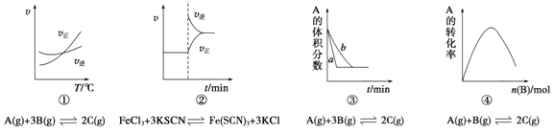
A. ①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C. ③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示转化关系中涉及到的物质均由主族元素组成(部分产物已略去),其中C、D为单质,A、B、E、F、G为化合物,除C与D的反应外,其它反应均在溶液中进行。请填写下列空白。
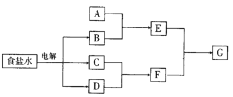
(1) 若A是常见的金属或金属氧化物,当F过量时,G为可溶性盐,则A的化学式为_________或_________。
(2) 若A是一种常见氧化物,不管F过量与否,G为同一种难溶性物质,则A的名称是________,晶体类型是_______,A的用途是_________。
(3) 若A是一种具有漂白性的气态氧化物,A是___;若A是一种无味的气态氧化物,A的电子式为______。
(4) 若A为有机化合物,如果A与G为同一物质,请写出两种A(不同类别物质)的结构简式:_____;_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJmol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____kJmol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___T2(填“>”、“<”或“=”);
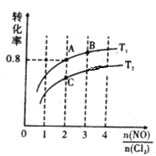
②图中纵坐标为物质___的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____(填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
I.可利用CH4与CO2制备合成气(CO、H2),在某一钢性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-A12O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)=2CO(g)+2H2(g)
(1)研究表明CO的生成速率![]() ,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=_________。
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
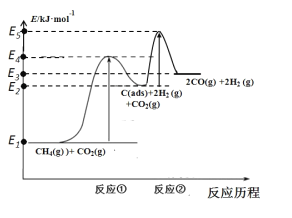
CH4与CO2制备合成气的热化学方程式为__________________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.CO2催化加氢制甲醇5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2,发生以下反应:
i. ![]() ,
,![]()
ii.. ![]()
iii. ![]()
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如右图所示。
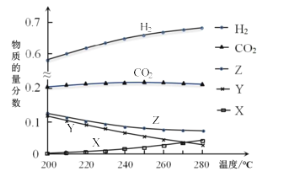
(4)①体系中CO2的物质的量分数受温度的影响不大,原因是_______________________。
②下列措施中,无法提高甲醇平衡产率的是________(填标号)。
A.加入适量CO B.增大压强C.循环利用原料气D.升高温度
③如上图X、Y分别代表_________、________(填化学式)。
III.利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
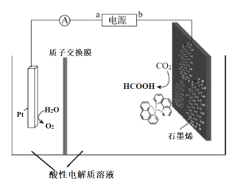
(5)①电池工作过程中,图中Pt电极附近溶液的pH_______(填“变大”或“变小”),阴极的电极反应式为________________。
②每转移2mol电子,阴极室溶液质量增加______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的模型如下图(图中的连线表示化学键),下列说法正确的是( )
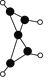
A. X能使溴的四氯化碳溶液褪色
B. X是一种在常温下能稳定存在的液态烃
C. X分子中在同一平面上的碳原子最多有5个
D. 充分燃烧等质量的X和甲烷,X消耗氧气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A. 4(b-2a)mol/L B. 20(2a-b)mol/L
C. 20(b-2a)mol/L D. 10(b-a)mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com