
| 生成的盐 | 化学式 | 质量/g |
| A | ||
| B |
分析 22.4L CO和CO2混合气体物质的量为1mol,若全部为CO,则质量应为28g,若全部为二氧化碳,质量应为44g,依据十字交叉法可以求出两者的物质的量之比,然后依据氢氧化钠的物质的量判断产物,以此解答该题.
解答 解:22.4L CO和CO2混合气体物质的量为1mol,若全部为CO,则质量应为28g,若全部为二氧化碳,质量应为44g,
即 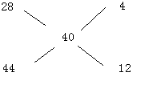 ,那么一氧化碳与二氧化碳的物质的量之比为4:12=1:3,即二氧化碳的物质的量为0.75mol,1L lmol/NaOH溶液物质的量为1mol,故生成产物为碳酸钠与碳酸氢钠的混合物,设碳酸钠为xmol,碳酸氢钠为ymol,依据碳元素守恒得:x+y=0.75①,依据钠元素守恒得:2x+y=1mol②,联立①②解得:x=0.25mol,y=0.5mol,即质量分别为:26.5g和42g,
,那么一氧化碳与二氧化碳的物质的量之比为4:12=1:3,即二氧化碳的物质的量为0.75mol,1L lmol/NaOH溶液物质的量为1mol,故生成产物为碳酸钠与碳酸氢钠的混合物,设碳酸钠为xmol,碳酸氢钠为ymol,依据碳元素守恒得:x+y=0.75①,依据钠元素守恒得:2x+y=1mol②,联立①②解得:x=0.25mol,y=0.5mol,即质量分别为:26.5g和42g,
故答案为:Na2CO3、26.5g;NaHCO342g.
点评 本题主要考查混合物的计算,为高频考点,侧重考查学生的分析能力和计算能力,找出一氧化碳与二氧化碳的物质的量关系是解决本题的关键,难度不大,注意十字交叉法的运用.


科目:高中化学 来源: 题型:选择题
| A. | 7 g乙烯和丙烯混合气体中的氢原子数目 | |
| B. | 0.5 mol Fe溶于过量HNO3溶液中,转移的电子数目 | |
| C. | 2.5 L 0.4 mol/L 的 Na2CO3 溶液中 CO32-数目 | |
| D. | 标准状况下,5.6 L CCl4含有的共价键数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
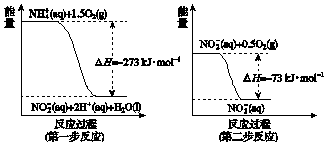
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向含NaOH、Ba(OH)2、NaAlO2各1mol的混合溶液中,缓慢通入CO2气体,产生沉淀的量与通入CO2的量图象关系如图所示,下列说法错误的是( )
向含NaOH、Ba(OH)2、NaAlO2各1mol的混合溶液中,缓慢通入CO2气体,产生沉淀的量与通入CO2的量图象关系如图所示,下列说法错误的是( )| A. | a点对应的溶液中,Na+、Fe3+、SO42-、HCO3-能大量共存 | |
| B. | c、d两点对应的溶液中,沉淀的质量相等 | |
| C. | d点对应的溶液中,c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | d点与e点对比,e点溶液的导电性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
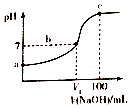 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )| A. | a点溶液的pH=4 | |
| B. | b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-) | |
| C. | b点c(HA)/c(A-)=5 | |
| D. | c点c(A-)+c(H+)=c(Na+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硝酸加入盛有铂、金的烧杯中,不反应,再加入一定量浓盐酸后,铂、金溶解,不能说明浓硝酸氧化性比浓盐酸强 | |
| B. | 石英玻璃、普通玻璃、陶瓷及水泥均属于硅酸盐产品 | |
| C. | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀,说明Al(OH)3胶体粒子带正电荷 | |
| D. | 气体甲通入溶液乙,溶液乙的颜色褪去,说明气体甲具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | - |
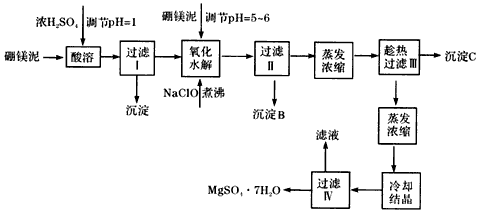
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com