

分析 无色溶液中一定不含MnO4-,由实验流程可知,X与过量盐酸反应生成气体A为CO2,则原溶液中一定含CO32-;结合离子共存可知原溶液中不含Ag+、Ba2+、Al3+,由电荷守恒可知一定含阳离子为Na+,反应①得到的溶液(含过量盐酸)与过量碳酸氢钠反应生成气体A为CO2,白色沉淀甲应为Al(OH)3,反应后溶液中含Al3+,可知原溶液中一定含AlO2-,溶液II与过量氢氧化钡反应生成气体B为NH3,白色沉淀乙一定含BaCO3,可能含有BaSO4,则原溶液中可能含SO42-,以此来解答.
解答 解:(1)由上述分析可知,气体A为CO2,气体B为NH3,沉淀甲为Al(OH)3,
故答案为:CO2;NH3;Al(OH)3;
(2)由上述分析可知,一定存在的离子为CO32-、AlO2-、Na+,故答案为:CO32-、AlO2-、Na+;
(3)步骤①发生反应的所有离子方程式为AlO2-+4H+=Al3++2H2O、CO32-+2H+=H2O+CO2↑,
故答案为:AlO2-+4H+=Al3++2H2O、CO32-+2H+=H2O+CO2↑;
(4)白色沉淀乙一定含有BaCO3,可能含有BaSO4,进一步确定其组成的操作是在沉淀乙中加入稀盐酸,若白色沉淀完全溶解,则沉淀乙只有BaCO3,若部分溶解,则沉淀由BaCO3和BaSO4组成,
故答案为:一定含有BaCO3,可能含有BaSO4;在沉淀乙中加入稀盐酸,若白色沉淀完全溶解,则沉淀乙只有BaCO3,若部分溶解,则沉淀由BaCO3和BaSO4组成.
点评 本题考查常见离子的检验,为高频考点,把握离子的性质、发生的反应、离子检验方法为解答该题的关键,侧重分析与实验能力的考查,注意各步反应中加试剂均过量,题目难度不大.


科目:高中化学 来源: 题型:解答题
 甲醇与甲醚(CH3OCH3)都可作燃料电池的燃料.
甲醇与甲醚(CH3OCH3)都可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$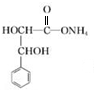 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 或
或 . (任写一种)
. (任写一种) ,现以甲苯和乙醛为原料制备3-苯基丙烯醛
,现以甲苯和乙醛为原料制备3-苯基丙烯醛 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和CO | B. | CO2和N2O | C. | O3和CO2 | D. | CO32-和NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c (CH 3COO -)>c (Na +)>c (CH 3COOH)>c (H +)>c (OH -) | |
| B. | 点①所示溶液中酸的中和率大于50% | |
| C. | 点②是二者恰好中和点 | |
| D. | 点③所示溶液中:c (Na +)>c (OH -)>c (CH 3COO -)>c (H +) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入氢氧化钠溶液,产生蓝色淀,一定有Cu2+ | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| D. | 加入过量盐酸,振荡、静置,再滴入氯化钡溶液,有白色沉淀产生,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 13种 | D. | 16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. .
. 或
或 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com