
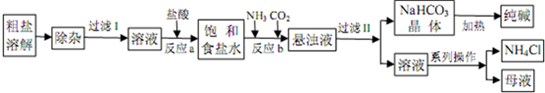
| 等级 | 优等品 | 一等品 | 合格品 |
| Na2CO3含量 | ≥99.2 | ≥98.8 | ≥98.0 |
| n |
| V |
| m(碳酸钠) |
| m(样品) |
| 2.34 |
| 100 |
| 1 |
| X |
| 1 |
| 0.0234mol |
| 0.0234mol |
| 0.05L |
0.0234×
| ||
| 10 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
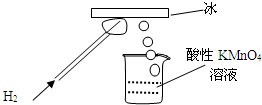 某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是
某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是| A、该条件下H2燃烧放出的热量使冰分解产生了氧气 |
| B、该条件下H2被冷却为液态氢,液氢的水溶液具有氧化性 |
| C、该条件下生成的物质具有氧化性和还原性 |
| D、该条件下生成的水分子化学性质比较活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
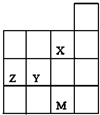
| A、Y、Z的最高价氧化物的水化物酸性为Y<Z |
| B、M的最外层电子数比Z大10 |
| C、X、M的气态氢化物的稳定性M>X |
| D、X、Y形成简单离子的最外层电子均满足8e-稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 稀氨水 | Al3+ | Mg2+ |
| B | 新制氯水、CCl4 | I- | Cl- |
| C | KSCN溶液、新制氯水 | Fe2+ | Fe3+ |
| D | 稀盐酸、BaCl2溶液 | SO42- | SO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
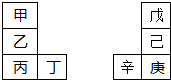
| A、金属性:甲>乙>丁 |
| B、原子半径:辛>己>戊 |
| C、丙与庚的原子核外电子数相差13 |
| D、乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
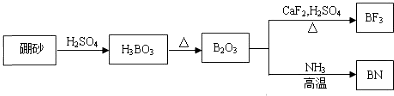
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com