
在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:A(g) +2B(g) 2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
A. 物质A、B的转化率之比为l:2
B. 起始时刻和达到平衡后容器中的压强之比为(a+b):(a+b-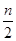 )
)
C. 当v正(A)=v逆(B)时,反应一定达到平衡状态
D. 充入惰性气体,平衡向逆反应方向移动
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:广东省2016-2017学年高一上学期期末考试化学试卷 题型:填空题
物质的分类方法有多种方法,下列对无机化合物分类如图:
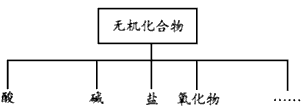
(1)上图所示的物质分类方法名称是____________________。
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、④、⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HNO3 ②_______ | ③NaOH ④_______ | ⑤Na2SO4 ⑥_______ | ⑦CO2 ⑧SO3 | ⑨NH3 |
(3)写出⑦与少量的③溶液反应的离子方程式_______________________。
(4)写出铝与③溶液反应的化学方程式______________________。
(5)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol· L-1的稀硫酸。
可供选用的仪器有:①胶头滴管②烧瓶③烧杯④ 玻璃棒⑤药匙⑥量筒⑦托盘天平。

请回答下列问题:
a.该硫酸的物质的量浓度为 __________ mol· L-1。
b.配制稀硫酸时,还缺少的仪器有 ______________ (写仪器名称)。
c.经计算,配制480mL 1mol· L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_________mL。
d.对所配制的稀硫酸进行测定,发现其浓度大于1 mol· L-1,配制过程中下列各项操作可能引起该误差的原因有 ___________。
A.定容时,俯视容量瓶刻度线进行定容 。
B.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作。
C.转移溶液时,不慎有少量溶液洒到容量瓶外面。
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水 。
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
2Mg+CO2 2MgO+C的反应类型属于
2MgO+C的反应类型属于
A. 复分解反应 B. 置换反应 C. 化合反应 D. 分解反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:简答题
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)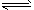 CH3OH(g)。
CH3OH(g)。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
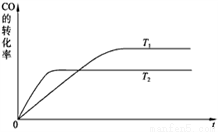
① 该反应的焓变ΔH____________0(填“<”、“>”或“=”)。② T1和T2温度下的平衡常数大小关系是K1____________K2(填“<”、“>”或“=”)。③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
①平衡常数K=________________。
②若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时V正______V逆(填“<”、“>”或“=”)。
(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
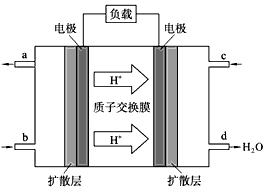
① 该电池工作时,b口通入的物质为____________。
② 该电池正极的电极反应式为 ___________________。
③ 工作一段时间后,当3.2g甲醇完全反应生成CO2时,有___________NA个电子转移。
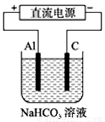
(4)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):_______________ 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
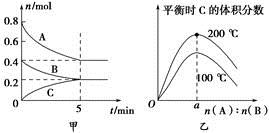
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温时,0.01 mol·L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是
A. 上述弱酸溶液的pH=4
B. 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大
C. 加入等体积0.01 mol·L-1NaOH溶液后,所得溶液的pH=7
D. 加入等体积0.01 mol·L-1NaOH溶液后,所得溶液的pH<7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:计算题
常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
下图所表示的一些物质或概念间的从属关系不正确的是( )
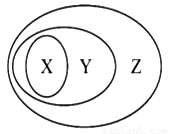
X | Y | Z | |
A | 干冰 | 氧化物 | 纯净物 |
B | 冰水混合物 | 电解质 | 化合物 |
C | 淀粉溶液 | 胶体 | 分散系 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:简答题
查尔酮是一种重要的化工原料,可以通过如下过程合成。请回答下列有关问题:
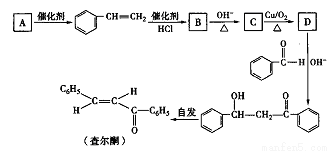
(1)已知A的分子式为C8H10,它的结构简式为_______。查尔酮的结构属于烯烃的_____ (填“顺式”或“反式”)异构。
(2) B转化成C的反应类刑属于________;C分子中含氧官能团为______。
(3)D物质在OH-存在时与苯甲醛反应的化学方程式为___________。
(4) D的同分异构体中,属于芳香醛的有_____种;其中核磁共振氢谱吸收峰种类最少的一种同分异构体的名称为________。
(5)参照上述合成路线,写出由CH3CH=CH2制取丙酮的流程图:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com