
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) 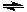 nY(g)ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是( )
nY(g)ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是( )
A.m>n B.体积不变,温度升高,平衡向逆反应方向移动
C.Q<0 D.温度不变,压强增大,Y的质量分数减少
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除。
Ⅰ.活性炭还原法处理氮氧化物。若向2L密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应生成甲和乙,甲和乙均为参与大气循环的物质,反应进行到不同时间测得各物质的物质的量浓度如下:
|
| NO | 甲 | 乙 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(1)该反应的化学方程式为_____________________________________________
(2)T1℃时,该反应的平衡常数K=______________
(3) 30min时改变的的条件是_______________。若30min后升高温度至T2,达到平衡时,容器中NO、甲、乙的浓度之比为2∶1∶1,则反应的△H__________0(填“<”、“=”、“>”)。
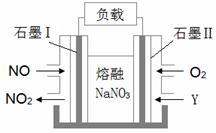 Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
(4)石墨电极Ⅰ的反应式为______________________;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入一种氧化物Y,Y是_______________(填物质的化学式)。
Ⅲ.CH4催化还原法。已知:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
②CH4(g)+2NO2(g)  N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
③H2O(g)=H2O(l) △H=-44.0kJ/mol
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________________。
(6)假设在某温度下反应①的速率(v1)大于反应②的速率(v2)则下列反应过程能量变化示意图正确的是________(填写正确选项的字母)。
|
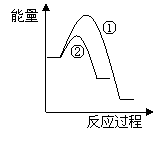
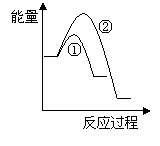
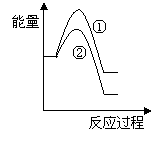
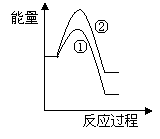


(7)恒温恒容条件下,假设反应①和②同时发生,且v1>v2,请在下图中画出反应体系中c(NO)随时间t变化的总趋势图。
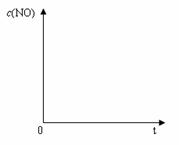
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
A.滴加石蕊溶液显红色的溶液:Fe3+、NH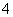 、C1-、SCN-
、C1-、SCN-
B.含有大量HCO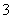 的溶液:NH
的溶液:NH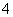 、Ca2+、Mg2+、I-
、Ca2+、Mg2+、I-
C.水电离的H+浓度为1×10-13mol·L-1溶液中:NH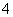 、Fe2+、SO
、Fe2+、SO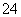 、NO
、NO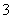
D.含有大量ClO-的溶液:OH-、K+、I-、SO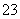
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A~H均含苯环,它们之间的转化关系如下。已知:B与FeCl3溶液混合无颜色变化。
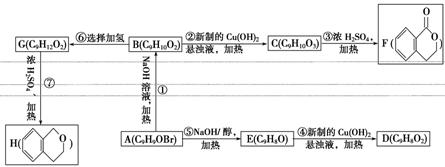
回答下列问题:
(1)B的结构简式为________。
(2)①~⑦中属于取代反应的是________(填序号)。
(3)写出一种可鉴别D、F的试剂:________。
(4)写出反应⑦的化学方程式:______________________________________________。
(5)写出同时符合下列条件的C的同分异构体的结构简式:________________________
________________________________________________。
①化合物是1,3,5三取代苯
②苯环上的三个取代基中分别含有醇羟基、酚羟基和醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示元素的基态原子的电子排布式,其中表示的元素属于第三周期的元素的是
A.1s22s1 B.1s22s22p5 C.1s22s22p63s2 D.1s22s22p63s23p64s1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X的电负性数值为2.5,元素Y的电负性数值是3.5,元素Z的电负性数值为1.2,元素W的电负性数值为2.4。你认为上述四种元素中,哪两种最容易形成离子化合物
A.X与Y B.X与W C.Y与Z D.Y与W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在标准状况下,1 mol水的体积是22.4 L
B.1 mol H2所占的体积约为22.4 L
C.在标准状况下,NA个分子所占的体积约为22.4 L
D.在标准状况下,1 mol NH3和CO混合气体所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
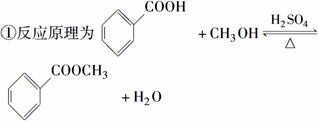
苯甲酸甲酯是一种重要的香料。其合成装置为
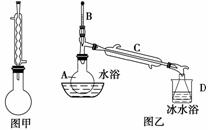
②反应物和产物的部分性质如下表所示:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 苯甲酸 | 249 | 1.265 9 | 微溶于水 |
| 甲醇 | 64.6 | 0.791 0 | 易溶于水 |
| 苯甲酸甲酯 | 198 | 1.090 0 | 不溶于水 |
③实验步骤如下:
步骤一:在干燥的圆底烧瓶(如图甲)中加入12.20 g苯甲酸和12.10 mL甲醇。边缓缓摇动边加入3 mL浓硫酸,再加上几粒固体X,装上冷凝管,加热。
步骤二:取下图甲所示冷凝管,在烧瓶上安装图乙所示的装置,利用热水浴加热烧瓶;一段时间后,冷却,将烧瓶中溶液倒入分液漏斗中,先用水洗涤,再用浓碳酸钠溶液洗涤即得粗苯甲酸甲酯。
步骤三:将苯甲酸甲酯重新加入图乙所示装置中,加热,收集一定温度下的馏分,即得纯净的苯甲酸甲酯,质量为8.84 g。
回答下列问题:
(1)步骤一中固体X的作用是防止暴沸,X的名称是________________________。
(2)图甲装置中冷凝管的作用是________________________________________。
(3)图乙装置中仪器A的名称是________,仪器D的名称是________。
(4)步骤二中热水浴的目的是______________________,在分液漏斗中用水洗涤的目的是__________________,用碳酸钠洗涤的目的是______________________。
(5)步骤三中收集的馏分温度范围为________。(填正确答案标号)
a.63~66 ℃ b.197~198 ℃
c.248~250 ℃ d.>250 ℃
(6)本实验中,苯甲酸甲酯的产率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com