
(16分)汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示): 。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
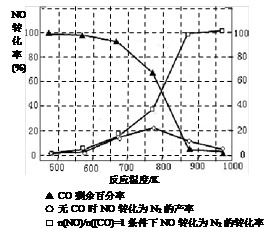
并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示: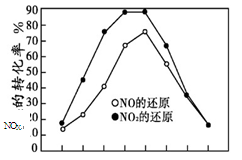
① 从图中可以得出的结论是
结论一:相同温度下, 。
结论二: 。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有 。(填编号)
| A.加入催化剂 | B.降低温度 |
| C.分离出H2O(g) | D.增大压强 |
 O2+Hb·CO K=220
O2+Hb·CO K=220(16分)
(1)2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=2△H3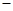 △H2
△H2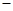 △H1
△H1
(4分;方程式、反应热各2分,配平正确但状态无写或标注错误扣1分)
(2)① 结论一: NO转化率比NO2的低 (2分)
结论二:在250°C~450°C时,NOX转化率随温度升高而增大,450°C~600°C时NOX转化率随温度升高而减小 (2分;其他合理答案也给分)
② BC (3分;只答对一个得1分,错选不给分)
(3)(5分) 肺部CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1,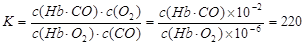 (2分)
(2分)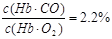 >2% (2分)
>2% (2分)
故:抽烟会造成人的智力损伤。 (1分)
解析试题分析:(1)根据盖斯定律,目标方程式=③×2-①-②,所以所求热化学方程式为
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=2△H3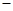 △H2
△H2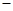 △H1
△H1
(2)① 从图中可以看到,二氧化氮的转化率曲线在NO转化率曲线的上方,所以得出的结论是,相同温度时,NO转化率比NO2的低;结论二:从曲线的变化情况可知,在250°C~450°C时,NOX转化率随温度升高而增大,450°C~600°C时NOX转化率随温度升高而减小;同时也可以说明,温度升高NOX转化率降低,则NOX转化反应是放热反应;
②A、加入催化剂,只能加快反应速率,不能改变平衡,所以二氧化氮的转化率不会提高,错误;B、有①的分析知该反应是放热反应,降低温度,平衡正向移动,二氧化氮的转化率提高,正确;C、分离出水蒸气,使生成物浓度降低,平衡正向移动,提高二氧化氮的转化率,正确;D、增大压强,平衡逆向移动,二氧化氮的转化率降低,错误,答案选BC;
(3)由K=220可知,220=c(O2)c(Hb·CO)/ c(Hb·O2) c(CO),CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。所以c(Hb·CO)/ c(Hb·O2)=220×10-6 mol·L-1/10-2 mol·L-1=2.2%>2%,所以抽烟会造成人的智力损伤。
考点:考查盖斯定律的应用,对图像的分析,平衡常数的应用,转化率的判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列热化学方程式中,ΔH的绝对值能表示可燃物的燃烧热的是( )
A.C(s)+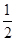 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 |
| B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
D.CO(g)+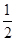 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据题意回答下列问题
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡时c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:稀溶液中,强酸与强碱反应中和热的数值为57.3kJ/mol。
(1)用0.1molBa(OH)2配成的稀溶液跟足量的稀硝酸反应,放出______kJ的热量
(2)1L0.1mol/LNaOH溶液分别与①醋酸溶液②浓硫酸③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ),则它们由大到小的顺序是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知1molCaCO3分解需要吸收178kJ 热量,1mol焦炭完全燃烧放出393.5kJ ,试回答下列问题
(1)写出碳酸钙分解的热化学反应方程式
(2)试计算如果0.5t CaCO3煅烧成CaO(s),在理论上要用焦炭多少千克。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修2:化学与技术】(15分)
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) 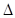 H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示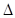 H,则
H,则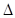 H= ;
H= ;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两
个水分子产物,其结构式为 ,三聚
磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 ;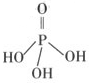
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑ 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;
原理上的不同点: ;
化学镀的优点: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。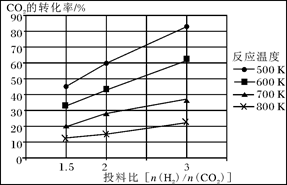
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
②CH4(g)+4NO(g)="=2" N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则CH4 (g)+2NO2(g)="=" N2(g)+CO2(g)+2H2O(g) ΔH=___________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图: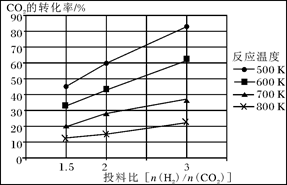
①此反应为 (填“放热”、“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池正极的电极反应式_______________________。
③在a MPa和一定温度下,将6 mol H2和2 mol CO2在2 L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率是多少?(计算结果保留2位有效数字)
④在a MPa和500K下,将10mol H2和5 mol CO2在2 L密闭容器中混合,5min达到平衡,请在答题卡的坐标图中画出H2浓度变化图。(请标出相应的数据)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)工业合成氨与制备硝酸一般可连续生产,流程如下: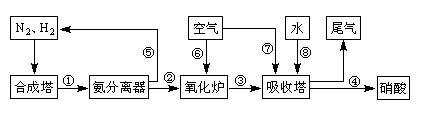
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com