
| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 无法估算 |
分析 设25%的酒精和5%的酒精的体积各取VL,根据溶质质量分数的表达式w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%进行计算.
解答 解:设25%的酒精和5%的酒精体积都为VL,
则混合后的氨水的质量分数为:w=$\frac{0.91V×25%+0.98V×5%}{0.91V+0.98V}$=14.6%<15%,
故选C.
点评 本题考查了有关溶质质量分数的简单计算,题目难度中等,注意明确:①密度比水大的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数大于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半),如氢氧化钠、氯化钠溶液等;②密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半),如氨水、酒精溶液等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:填空题
在炼油工业中常用醋酸铜氨溶液{含[Cu(NH3)2]+、CH3COO-和NH3}除去H2中的CO、O2及H2S气体。
(1)已知醋酸铜氨溶液吸收CO的反应为:
[Cu(NH3)2]+(aq)+CO(g)+NH3(g)  [Cu(NH3)3·CO]+(aq)
[Cu(NH3)3·CO]+(aq)
若反应在恒容密闭容器中进行,则能说明该反应已达到平衡状态的是 。
a.v(CO)正=v(NH3)正
b.容器内气体压强不再随时间变化
c.[Cu(NH3)2]+浓度不再随时间变化
(2)醋酸铜氨溶液吸收CO一段时间后将失效,用下列方法可回收废醋酸铜氨溶液中的铜。

“预处理”时,尾气中除N2、CO、O2、CO2及H2O外,还有 。
②加入硫化钠溶液时发生反应的离子方程式为 。
③加入硝酸时发生反应的化学方程式为 。
④已知上述流程中只有“沉铜”和“结晶”步骤铜元素有损耗。“沉铜”时铜元素的损耗率为4%;“结晶”时铜元素的损耗率为2%。若1L废液最终制得Cu(NO3)2·3H2O 363g,则1L废液中铜元素的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
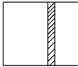 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )| A. | 物质A、B的转化率之比为a:b | |
| B. | 起始时刻和达平衡后容器中的压强比为(a+b):(a+b-$\frac{n}{2}$) | |
| C. | 若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C | |
| D. | 当v正(A)=2v逆(B)时,可判定反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水解平衡正向移动 | B. | 各微粒浓度均变小 | ||
| C. | 溶液中离子数目增多 | D. | c(Al3+)与c(SO42-)的比值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
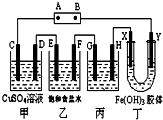 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
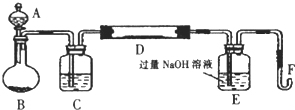
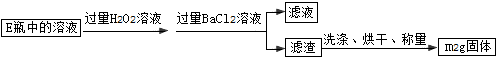
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)=c(SO42-) | |
| B. | c(Ba2+)增大,c (SO42-) 减小 | |
| C. | c(Ba2+)≠c SO42-),c(Ba2+)•c(SO42-)=KSP(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠KSP(BaSO4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com