
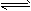 2HI (g)����H��0 ��Ӧ���ʵ�Ӱ�죬����±���ʾʵ��
2HI (g)����H��0 ��Ӧ���ʵ�Ӱ�죬����±���ʾʵ��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ������������Ҫ���������ͻ�ԭ����������������ɱ����Ư�ȣ�ij��ѧ��ȤС��ͬѧΧ���Ź������չ�˵����о���ʵ�飮
������������Ҫ���������ͻ�ԭ����������������ɱ����Ư�ȣ�ij��ѧ��ȤС��ͬѧΧ���Ź������չ�˵����о���ʵ�飮
| ||
| ||
| ʵ���� | T/�� | H2O2��ʼŨ��/ mol?L-1 |
FeCl3��ʼŨ��/ mol?L-1 |
| �� | 20 | 1.0 | 0 0 |
| �� | 50 | 1.0 | 0 |
| �� | 50 | 1.0 1.0 |
0.1 |
| ��һ�� | �ڶ��� | ������ | ���Ĵ� | |
| �����mL�� | 17.10 | 18.10 | 18.00 | 17.90 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ÷���и����ܸ�ϰ�ʼ��Ծ����ۻ�ѧ�Ծ��������棩 ���ͣ������
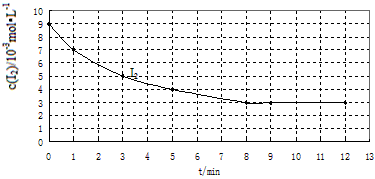
��ҵ���ڴ��������¿�����CO�ϳɼ״���CO(g)+2H2(g)  CH3OH(g)��ͼ1��ʾ��Ӧ�����������ı仯�����
CH3OH(g)��ͼ1��ʾ��Ӧ�����������ı仯�����

��ش��������⣺
��1����ͼI�У�����______(�a����b������ʾʹ���˴������÷�Ӧ����______(����ȡ����ȡ�����Ӧ��
��2��Ϊ̽����������Ժϳɼ״���ѧ��Ӧ���ʵ�Ӱ����ɣ�ij�Ƽ��������������������ʵ�飬�������������˱��У��벹��������
|
ʵ���� |
T/�� |
��ʼŨ��/mol•L��1 |
������������ �ȱ����/m2•g��1 |
|
|
CO |
H2 |
|||
|
�� |
280 |
1.20��10��3 |
5.80��10��3 |
82 |
|
�� |
280 |
1.20��10��3 |
5.80��10��3 |
124 |
|
�� |
350 |
|
|
124 |
�������ʵ����ٺ͢ڵ�Ŀ����______��
��3����ͼ2������ʾ�Ĺ����ǣ���p1ѹǿ��ƽ��ʱ______�����뻭����p2ѹǿ�£�p2 > p1)�����ߡ�
��4���ڼ��������¿ɽ��ϳɼ״��ķ�Ӧ��Ƴ�ԭ��أ����ĵ缫��ӦʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���㽭ʡ�����߿�ģ�����⣨���ۣ���ѧ���� ���ͣ�ѡ����
��I���������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӡ�
��1��Ŀǰ���ó��ٽ�CO2����״̬������̬��Һ̬֮�䣩���������������ѳ�Ϊһ�����ƣ���һ�����Ի����Ļ����������� ��
��2����CO2ת�����л������Чʵ��̼ѭ����CO2ת�����л�������Ӻܶ࣬�磺

���Ϸ�Ӧ�У�����ܵ��� ��ԭ����������ߵ��� ��
��3��Ϊ̽����CO2������ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺
�����Ϊ1L���ܱ������У�����1molCO2��3molH2��һ�������·�����Ӧ��
CO2��g��+3H2��g�� CH3OH��g��+H2O��g����H=��49.0kJ/mol
CH3OH��g��+H2O��g����H=��49.0kJ/mol
���CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��

�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��= ���������������� ��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽΪ �������¶ȣ�ƽ�ⳣ������ֵ��
�����������С�����䡱����
�����д�ʩ����ʹn��CH3OH��/n��CO2��������� .
A�������¶� B������He��g����ʹ��ϵѹǿ����
C����H2O��g������ϵ�з��� D���ٳ���1molCO2��3molH2
��II�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ���Ȼ�ѧ����ʽ���£�
N2��g��+3H2��g��  2NH3��g�� ��H=-93.4kJ/mol
2NH3��g�� ��H=-93.4kJ/mol
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ������������ı�N2��H2��NH3����������Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ��


ͼt1ʱ����ƽ���ƶ������������� ��
���б�ʾƽ��������NH3������ߵ�һ��ʱ���� ��
���¶�ΪT��Cʱ����3amolH2��amolN2������ͼ��ʾ���ܱ������У�������������������ƶ�����ַ�Ӧ����N2��ת����Ϊ50%���������ͬ�¶��½�3amolH2��amolN2��2amolNH3�������������У�ƽ��ʱH2���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10�꽨�����и߶���ѧ����ĩ���Ի�ѧ�� ���ͣ������
(12��)���������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӡ�
��1��Ŀǰ���ó��ٽ�CO2����״̬������̬��Һ̬֮�䣩���������������ѳ�Ϊһ�����ƣ���һ�����Ի����Ļ����������� ��
��2����CO2ת�����л������Чʵ��̼ѭ����CO2ת�����л�������Ӻܶ࣬�磺
���Ϸ�Ӧ�У�����ܵ��� ��ԭ����������ߵ��� ��
��3��Ϊ̽����CO2������ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺
�����Ϊ1L���ܱ������У�����1molCO2��3molH2��һ�������·�����Ӧ��
 CO2��g��+3H2��g�� CH3OH��g��+H2O��g����H=-49.0kJ/mol
CO2��g��+3H2��g�� CH3OH��g��+H2O��g����H=-49.0kJ/mol
���CO2��CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
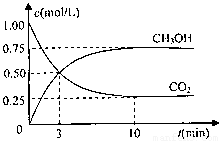
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��= mol/��L��min��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽΪ �������¶ȣ�ƽ�ⳣ������ֵ��
�����������С�����䡱����
�����д�ʩ����ʹn��CH3OH��/n��CO2��������� .
A�������¶� B������He��g����ʹ��ϵѹǿ����
C����H2O��g������ϵ�з��� D���ٳ���1molCO2��3molH2
��4�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ���Ȼ�ѧ����ʽ���£�
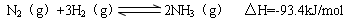
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ������������ı�N2��H2��NH3����������Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ��
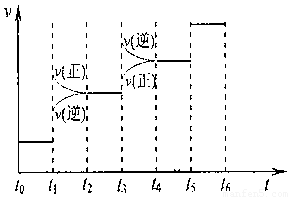
ͼt1ʱ����ƽ���ƶ������������� ��
���б�ʾƽ��������NH3������ߵ�һ��ʱ���� ��
���¶�ΪT��Cʱ����3amolH2��amolN2������л������ܱ������У���������������ƶ�����ַ�Ӧ����N2��ת����Ϊ50%���������ͬ�¶��½�3amolH2��amolN2��2amolNH3�������������У�ƽ��ʱH2��ת����Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com