�⣺�ɢ�X��Y��Z��W����ɫ��Ӧ��Ϊ��ɫ��֤������Ԫ�أ�
����Z��W�м���ϡ���ᣬ������ɫ������ζ������ų������ƶ�Ϊ̼���ƻ�̼�����ƣ�
��Y��Z��W�ֱ���������Ba��OH��
2Ũ��Һ��Ӧ�����а�ɫ�������ɣ��ټ���������ᣬ��Z��W���ɵİ�ɫ�������ܽ⣬��Y���ɵİ�ɫ�������ܽ⣬֤��ZWΪ̼���ƺ�̼�����ƣ�Y����Ϊ�����ƻ��������ƣ�
������ͬ�����£���������Y����Һ�ֱ�ӵ���ͬ���ʵ���Ũ�ȡ���ͬ�����Z��W����Һ�У��������ݳ��֣�����W��Һ�����ݳ��ֽϿ죬˵��Yһ��ΪNaHSO
4��
��X��CO
2��Ӧ����Z���ƶ�ZΪNa
2CO
3��WΪNaHCO
3��ͬʱ������һ�����壬�������ɵؿ��к�������Ԫ����ɣ��ж�ΪO
2������XΪNa
2O
2��
����������XΪNa
2O
2��YΪNaHSO
4��ZΪNa
2CO
3��WΪNaHCO
3��
��1�����ݷ����ж�X�Ļ�ѧʽΪNa
2O
2��Y�Ļ�ѧʽΪNaHSO
4���ʴ�Ϊ��Na
2O
2��NaHSO
4��
��2����Z��Na
2CO
3��+ʯ��ˮ��Ӧ�����ӷ���ʽ��Ca
2++CO
32-�TCaCO
3�����ʴ�Ϊ��Ca
2++CO
32-�TCaCO
3����
��X��Na
2O
2��+CO
2����Ӧ��ѧ����ʽ��2Na
2O
2+2CO
2=2Na
2CO
3+O
2���ʴ�Ϊ��2Na
2O
2+2CO
2=2Na
2CO
3+O
2��
��W

��Ӧ�Ļ�ѧ����ʽ��2NaHCO
3
Na
2CO
3+H
2O+CO
2�����ʴ�Ϊ��2NaHCO
3
Na
2CO
3+H
2O+CO
2����
������X��Y��Z��WΪ���ֹ��廯���ʵ���������£�
��X��Y��Z��W����ɫ��Ӧ��Ϊ��ɫ��֤������Ԫ�أ�
����Z��W�м���ϡ���ᣬ������ɫ������ζ������ų������ƶ�Ϊ̼���ƻ�̼�����ƣ�
��Y��Z��W�ֱ���������Ba��OH��
2Ũ��Һ��Ӧ�����а�ɫ�������ɣ��ټ���������ᣬ��Z��W���ɵİ�ɫ�������ܽ⣬��Y���ɵİ�ɫ�������ܽ⣬֤��ZWΪ̼���ƺ�̼�����ƣ�Y����Ϊ�����ƻ��������ƣ�
������ͬ�����£���������Y����Һ�ֱ�ӵ���ͬ���ʵ���Ũ�ȡ���ͬ�����Z��W����Һ�У��������ݳ��֣�����W��Һ�����ݳ��ֽϿ죬˵��Yһ��ΪNaHSO
4��
��X��CO
2��Ӧ����Z���ƶ�ZΪNa
2CO
3��WΪNaHCO
3��ͬʱ������һ�����壬�������ɵؿ��к�������Ԫ����ɣ��ж�ΪO
2������XΪNa
2O
2��
����������XΪNa
2O
2��YΪNaHSO
4��ZΪNa
2CO
3��WΪNaHCO
3��
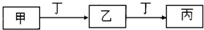
���������⿼��������ת����ϵ�ķ����жϣ��������ʵ�Ӧ�ã���Ҫ�����Ƽ��仯���������Ӧ�ã����ӷ���ʽ����ѧ����ʽ����д��������Ӧ��������������ǽ���ؼ���

 ����ѧ����ʽ��______��
����ѧ����ʽ��______�� ��Ӧ�Ļ�ѧ����ʽ��2NaHCO3
��Ӧ�Ļ�ѧ����ʽ��2NaHCO3 Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3 Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����






 ��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ��������������X�������Ӿ���һ�����ӣ�Z��W�����ڱ��ڴ���ͬһ��������λ�ã����ǵĵ�����ͨ��״���¾�Ϊ��ɫ���壮Yԭ�ӵ������������Ǵ�����������2������ش�
��X��Y��Z��W���ֶ�����Ԫ�أ�ԭ��������������X�������Ӿ���һ�����ӣ�Z��W�����ڱ��ڴ���ͬһ��������λ�ã����ǵĵ�����ͨ��״���¾�Ϊ��ɫ���壮Yԭ�ӵ������������Ǵ�����������2������ش�