


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、原子晶体干冰有很高的熔点、沸点,有很大的硬度 |
| B、原子晶体干冰易汽化,可用作制冷材料 |
| C、原子晶体干冰硬度大,可用作耐磨材料 |
| D、每摩尔原子晶体干冰中含2 mol C-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
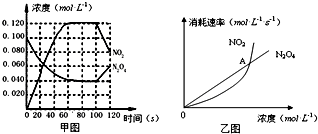
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 与
与 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、发酵粉能使烘焙出的糕点疏松多孔,是因为发酵粉中含有碳酸钠 |
| C、针对甲型H1N1流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
| D、加碘食盐中添加碘酸钾而不是碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com